
| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |
分析 A、反应是可逆反应不能进行彻底;
B、热化学方程式的焓变是指对应化学方程式量全部完全反应放出的热量,与催化剂无关;
C、低温反应速率慢,高压对设备要求高,成本高,而实际的转化率变化很小;
D、工业生产中,在吸收塔内用98.3%的浓硫酸吸收SO3.
解答 解:A、反应是可逆反应不能进行彻底,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量小于196.6kJ,故A错误;
B、催化剂只能改变反应所需的活化能,不能改变焓变,故B错误;
C、在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率,因为低温反应速率慢,高压对设备要求高,成本高,而实际的转化率变化很小,故C正确;
D、工业生产中,在吸收塔内用98.3%的浓硫酸吸收SO3.不能直接用水吸收,因为容易形成酸雾且吸收效率低,故D错误.
故选:C.
点评 本题考查了热化学方程式和焓变的关系分析、化学平衡移动与实际生产生活的联系,理解应用是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 常见气态氢化物的稳定性:X<Y<Z | |
| C. | 1molWM溶于足量水中完全反应,共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
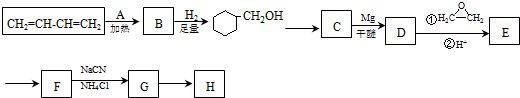
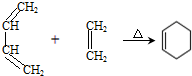

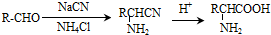
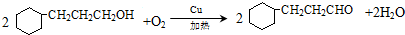 .
.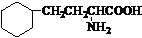 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式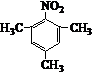 、
、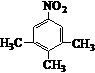 .
.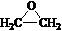 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素最高化合价的顺序为Z>Y>T>X | |
| B. | Y、Z分别形成的简单氢化物的稳定性为Z>Y | |
| C. | 由X、Y和Z三种元素构成的强电解质,对水的电离均起抑制作用 | |
| D. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
| 丙烯酸 | 142℃ | 与水互溶,易溶于有机溶剂 | 54℃ | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 11℃ | 有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
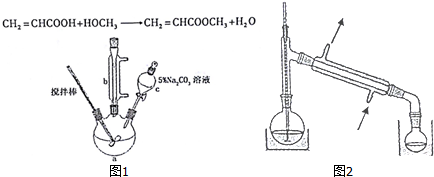
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>X>Y | |
| B. | 最高价氧化物的水化物酸性强弱W>Z>Y | |
| C. | 简单气态氢化物的稳定性Z>W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com