
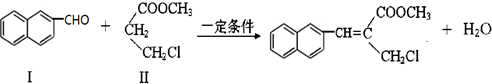
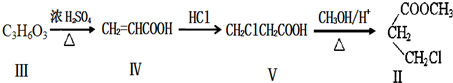
| 醇 |
| △ |
| 醇 |
| △ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、A(气)+B(气)?C(气) |
| B、A(气)+2B(气)?3C(气) |
| C、A(气)+B(气)?C(气)+D(气) |
| D、以上都达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应速率增大,逆反应速率减小,平衡一定向正反应方向移动 |
| B、正反应速率减小,逆反应速率减小,平衡一定向逆反应方向移动 |
| C、若同时扩大容器体积,则正逆反应速率一定都减小,平衡向逆反应方向移动 |
| D、若温度降低至氨气液化,则平衡一定向正反应方向移动,氨气产率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A、通入标况下的CO2气体为22.4L |
| B、A溶液中既含Na2CO3,又含NaHCO3 |
| C、A溶液中n(NaOH)=2n(Na2CO3) |
| D、A溶液中一定只有Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com