
| A.H2O | B.CCl4 | C.NH3 | D.CH4 |
科目:高中化学 来源:不详 题型:单选题
| A.盖斯定律实质上是能量守恒定律的体现 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| C.由C(石墨)―→C(金刚石);ΔH=+73 kJ/mol,可知石墨比金刚石稳定 |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);ΔH=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| B.从C(石墨)==C(金刚石) ΔH=+1.19 kJ·mol-1,可知:金刚石比石墨更稳定 |
| C.由H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,可知:含0.5 mol H2SO4的浓溶液与含1 molNaOH的溶液混合,放出热量大于57.3 kJ |
| D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl和NaOH反应的中加热△H ="-57.3" kJ/mol,则H2SO4和Ca(OH) 2反应的 中和热△H =2×(-57.3)kJ/mol |
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) 2CO(g)+O2(g)反应 2CO(g)+O2(g)反应的△H =" +2×283.0" kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知2H2O(g) =2H2(g)+O2(g) △H=+483.6 kJ/mol,则氢气的燃烧热为△H=-241.8kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s)△H>0,则金刚石不如石墨稳定 |
| C.已知中和热为△H=-57.4kJ/mol,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2 (g) △H1;2C(s)+O2 (g)=2CO(g) △H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由:H+(aq) + OH-(aq) = H2O(l)△H = -57.3kJ/mol,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3 kJ |
| B.从C(石墨)= C(金刚石) △H =" +" 119kJ/mol,可知:金刚石比石墨更稳定 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| D.没有单质参加的化合反应可能为氧化还原反应,也可能为放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)的反应过程和能量关系图,下列说法正确的是( )
2Z(g)的反应过程和能量关系图,下列说法正确的是( )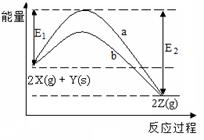
| A.曲线a和b表示两个反应过程的反应热不同 |
| B.曲线a一定表示反应是在无催化剂时的反应过程 |
| C.增大压强,X的转化率一定增大 |
| D.反应达到平衡后,升高温度,平衡常数K值一定减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com