
 如图所示装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )
如图所示装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )| A. | a是Ag、b是Fe、c为AgNO3溶液 | B. | a是Fe、b是Ag、c为AgNO3溶液 | ||
| C. | a是Zn、b是Cu、c为稀H2SO4 | D. | a是Cu、b是Zn、c为稀H2SO4 |
分析 原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析.
解答 解:该原电池中,a极逐渐变粗,同时b极逐渐变细,所以b作负极,a作正极,b的活泼性大于a的活泼性,所以排除BC选项;
a极逐渐变粗,说明有金属析出,D选项析出氢气不是金属,A选项析出金属,所以A符合题意.
故选A.
点评 本题考查了原电池原理,难度不大,明确正负极的判断方法,注意不能仅根据金属的活泼性判断正负极,要根据发生反应的反应类型判断正负极,如:Mg、Al、NaOH溶液构成的原电池,铝作负极,镁作正极.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )
异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )| A. | 1:1:1 | B. | 4:4:3 | C. | 5:4:3 | D. | 3:5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②⑤ | C. | ⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
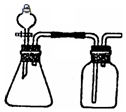 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )| A. | ①⑤⑥ | B. | ①③⑥ | C. | ①②⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取sp3杂化,NH4+中HNH键角比NH3中HNH键角大,原因是氨气分子中氮原子上有一对孤对电子,铵根离子中氮原子上没有孤对电子,排斥力小.
(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取sp3杂化,NH4+中HNH键角比NH3中HNH键角大,原因是氨气分子中氮原子上有一对孤对电子,铵根离子中氮原子上没有孤对电子,排斥力小.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向该体系中通入过量的二氧化硫,则氧气的转化率可达到100% | |
| B. | 该反应过程中SO2和O2的总能量一定低于SO3的总能量 | |
| C. | 当达到化学平衡时,该容器中SO2和SO3共2mol | |
| D. | 当达到反应限度时,单位时间内生成nmolO2,同时消耗2n molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com