
分析 Q蒸气对氢气的相对密度是29,相同条件下的气体密度之比等于其相对分子质量之比,所以Q的相对分子质量为58;5.8gQ的物质的量是0.1mol,13.2g二氧化碳为0.3mol,0.3molCO2中n(C)=0.3mol,0.3molH2O中n(H)=0.6mol,所以Q分子中含有3个C原子和6个H原子;Q能够发生酯化反应,则Q中含有O,根据Q的相对分子量确定O原子数;再结合Q分子中不含甲基,且为链状结构判断Q的结构简式.
解答 解:Q蒸气对氢气的相对密度是29,相同条件下的气体密度之比等于其相对分子质量之比,所以Q的相对分子质量为:2×29=58,
5.8gQ的物质的量是:$\frac{5.8g}{58g/mol}$=0.1mol,
13.2g二氧化碳的物质的量为:$\frac{13.2g}{44g/mol}$=0.3mol,0.3molCO2中n(C)=0.3mol,
0.3molH2O中n(H)=0.6mol,
所以Q分子中含有3个C原子和6个H原子,由于能够发生酯化反应,其分子中一定含有O元素,含有氧原子的数目为:$\frac{58-12×3-1×6}{16}$=1,
则Q的分子式为:C3H6O,
Q分子中不含甲基,且为链状结构、能够发生酯化反应,
则Q分子中含有碳碳双键和羟基,结合C=C-OH不稳定可知Q的结构简式为:CH2=CH-CH2-OH,
答:Q的结构简式为CH2=CH-CH2-OH.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 将大小相同的K和Na放入等体积的水中,钾比钠反应剧烈 | 钾元素的金属性比钠元素强 |
| B | 将Ba(OH)2•8H2O和NH4Cl晶体在小烧杯中混合,用手触摸烧杯外壁感觉变凉 | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 |
| C | 向盛有H2O2溶液的试管中,加入少量FeCl3溶液,产生气泡的速率比不加FeCl3溶液的快 | FeCl3可以加快H2O2分解的速率,起了催化作用 |
| D | 向酸性KMnO4溶液中通入SO2气体,KMnO4溶液紫色褪去. | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 贝诺酯分子中只有一种官能团 | |
| B. | 两种反应物均能与NaHCO3溶液反应放出CO2 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,生成三种羧酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸铵和水 | B. | 浓硫酸和水 | C. | 生石灰和水 | D. | 苛性钠和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知H2O(l)═H2O(g)△H=+44 kJ•mol-1,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的能量 | |
| C. | 吸热反应一定是非自发的化学反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
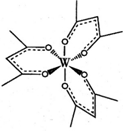 现有原子序数小于36的X、Y、Z、W四种元素.其中X元素的一种核素核内无中子;Y是地壳中含量最多的金属元素;Z原子的质量数为12,质子数与中子数相等;W的基态原子核外3d轨道上的电子数是最外层电子数的3倍.请回答下列问题:
现有原子序数小于36的X、Y、Z、W四种元素.其中X元素的一种核素核内无中子;Y是地壳中含量最多的金属元素;Z原子的质量数为12,质子数与中子数相等;W的基态原子核外3d轨道上的电子数是最外层电子数的3倍.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com