
【题目】下列物质的转化在给定条件下能实现的是( )
A.NaCl(aq) ![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2 ![]() Cu(OH)2
Cu(OH)2 ![]() Cu
Cu
C.Al ![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
D.MgO(s) ![]() Mg(NO3)2(aq)
Mg(NO3)2(aq) ![]() Mg(s)
Mg(s)
【答案】C
【解析】解:A、在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3 , 加热NaHCO3分解生成碳酸钠,在碱性条件下二氧化碳的溶解度大,中性条件下不能产生足够的碳酸氢根离子,故A错误;B、与氢氧化铜的悬浊液加热生成砖红色的氧化亚铜,而不是单质铜,故B错误;
C、铝与氢氧化钠反应生成偏铝酸钠,然后在碱性溶液中蒸发结晶,得到偏铝酸钠固体,故C正确;
D、电解Mg(NO3)2(aq)得到氢氧化镁,而得不到单质镁,故D错误;
故选C.
【考点精析】解答此题的关键在于理解铝的化学性质的相关知识,掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应.


科目:高中化学 来源: 题型:
【题目】利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如图. 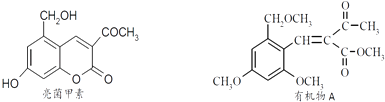
(1)“亮菌甲素”的分子式为: , 1mol“亮菌甲素”跟溴水反应时最多消耗mol Br2;能发生水解反应的官能团名称是 , 能发生还原反应的官能团名称是
(2)有机物A能发生如下转化,其中G分子中的碳原子在一条直线上. 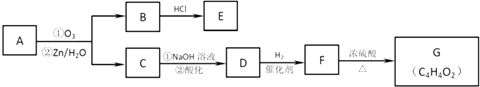
信息提示:i. ![]()
ii.R﹣O﹣CH3 ![]() R﹣OH(R为脂肪烃或芳香烃基)
R﹣OH(R为脂肪烃或芳香烃基)
①B→E的化学方程式是: .
②G的结构简式是: .
③H是G的一种同分异构体,可以发生水解反应,写出其结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组拟制备氯气并验证其一系列性质,实验装置如图所示(省略夹持装置).已知:硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂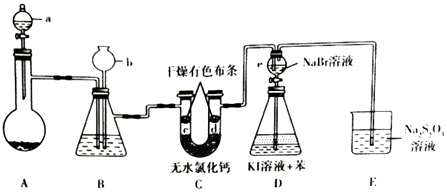
回答下列问题:
(1)仪器a的名称是 , 其中盛有浓盐酸,烧瓶A 中盛有的固体试剂是(填化学式).
(2)装置B中盛有饱和NaCl溶液,装置B的作用是 .
a.除去C12中的杂质HCl b.干燥 c.提供后续水蒸气 d.观察装置是否堵塞
(3)c处有色布条褪色,而d处不褪色,这说明 .
(4)实验结束后,打开e 的活塞,使其中的溶液流人到锥形瓶D中,摇匀锥形瓶,静置后可观察到
(5)装置E中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容器闭容器中发生可逆反应:2NH3(g)![]() N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
NH3 | N2 | H2 | ||
① | 2 | 0 | 0 | 吸收热量a kJ |
② | 0 | 1 | 3 | 放出热量b kJ |
③ | 4 | 0 | 0 | 吸收热量c kJ |
下列叙述正确的是( )
A.热量关系:a=b
B.①②③反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使酚酞变红的溶液中:Mg2+、Al3+、NO3﹣、ClO﹣
B.与Al反应能放H2的溶液中:Na+、Cu2+、NO3﹣、I﹣
C.0.1 mol?L﹣1Na2CO3溶液中:NH4+、K+、SO42﹣、Cl﹣
D.![]() =1×1012的溶液中:Ca2+、Na+、SiO32﹣、HCO3﹣
=1×1012的溶液中:Ca2+、Na+、SiO32﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应aA(g)+bB(g)![]() cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:
cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:![]() =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)
=K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
(1)若升高温度到950℃,达到平衡时K________(填“大于”、“小于”或“等于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为1mol/(Lmin),则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol/(Lmin)
B.1 mol/(Lmin)
C.2 mol/(Lmin)
D.3 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O). 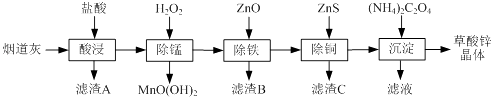
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣A的主要成分为 .
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为 .
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为 . ②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是 .
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是 .
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如下图所示,300℃~460℃范围内,发生反应的化学方程式为 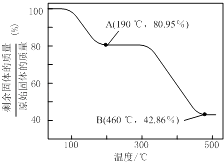
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在常温下能与SiO2反应的有 ( )
A. ①②⑥ B. ①③ C. ①③⑤ D. ②③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com