
| A. | 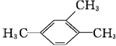 1,3,4-三甲苯 1,3,4-三甲苯 | B. | 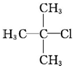 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | C. | 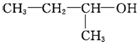 2-丁醇 2-丁醇 | D. | 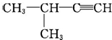 2-甲基-3-丁炔 2-甲基-3-丁炔 |
分析 对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小,据此解答即可.
解答 解:A、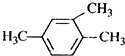 1,3,4-三甲苯,名称中取代基位次和不是最小,正确名称为1,2,4-三甲基苯,故A错误;
1,3,4-三甲苯,名称中取代基位次和不是最小,正确名称为1,2,4-三甲基苯,故A错误;
B、 2-甲基-2-氯丙烷,符合系统命名方法,故B正确;
2-甲基-2-氯丙烷,符合系统命名方法,故B正确;
C、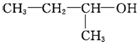 为醇类,选取距离羟基最近的一端命名为1号碳,正确的名称为2-丁醇,故C正确;
为醇类,选取距离羟基最近的一端命名为1号碳,正确的名称为2-丁醇,故C正确;
D、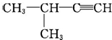 2-甲基-3-丁炔名称中编号的起点错误,正确的名称为3-甲基-1-丁炔,故D错误;
2-甲基-3-丁炔名称中编号的起点错误,正确的名称为3-甲基-1-丁炔,故D错误;
故选BC.
点评 本题考查了有机物质系统命名方法的应用,选最长的主链,编最近的起点和官能团,写规范的名称,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要想使AlCl3溶液中的Al3+几乎全部沉淀出来,可以加入过量的氨水 | |
| B. | 向FeCl2溶液中加入氨水,最终会看到红褐色沉淀 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 氢氧化钠、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
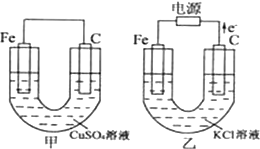 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
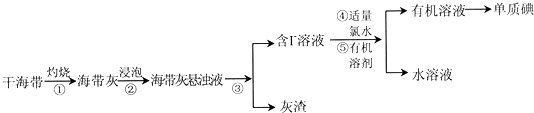
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 | ||
| HCl | NaOH | 平均值 | (t2-t1)/℃ | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
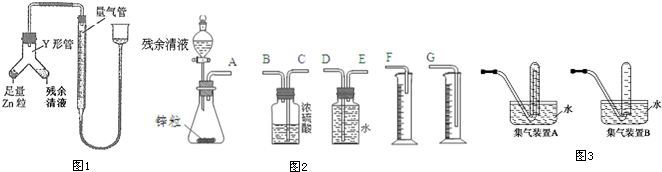
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液.
;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加Fe2O3的量 | B. | 增加Fe的量 | ||
| C. | 充入N2,保持容器内压强不变 | D. | 充入N2,保持容器内体积不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com