
| 1 |
| 2 |
| ||
| m |
| V |
| ||
| 1 |
| 2 |
| ||
| 2m |
| 78 |
| m |
| 78 |
| 2m |
| 78 |
| m |
| 78 |
| 67.2m |
| 78 |
| m |
| V |
| mg | ||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 顺序 | 甲 | 乙 | 丙 | 丁 |
| A | BaCl2 | Na2CO3 | KCl | K2CO3 |
| B | 硝酸 | 硝酸 | 盐酸 | 盐酸 |
| C | Na2CO3 | AgNO3 | K2CO3 | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热分解法适用于制备不活泼金属 |
| B、热还原法的常用还原剂为C、H2、CO、Al等 |
| C、电解法适用于制备不活泼金属 |
| D、水溶液中的置换法适用于较活泼金属制取不活泼金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
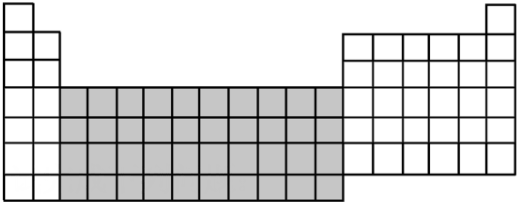
| 元素 | A | B | C | D | E | F |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 |
| 原子半径/nm | 0.074 | 0.075 | 0.077 | 0.102 | 0.160 | 0.186 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
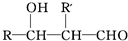 据此推断,合成
据此推断,合成 的两种醛为( )
的两种醛为( )A、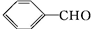  |
B、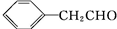 CH3CH2CHO CH3CH2CHO |
C、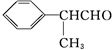 CH3CHO CH3CHO |
D、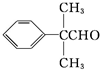 HCHO HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与O2反应可生成Na2O2,推论:K与O2反应也可生成K2O2 |
| B、F的最低化合价为-1价,推论:Cl的最低化合价也为-1价 |
| C、原子半径大小:C>N>O,推论:原子半径大小:Na>Mg>Al |
| D、H2O在常温下呈液态,推论:H2S在常温下也呈液态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com