
下列说法正确的是
A.氯化氢的摩尔质量为 36.5g
B.1molH2SO4的质量为98 g·mol-1
C.任何物质的摩尔质量都等于他的相对分子质量或相对原子质量
D.CO2的摩尔质量是H2的摩尔质量的22倍
科目:高中化学 来源:2015-2016学年重庆一中高一上学期10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.11.2L NO2含氧原子数为NA
B.标准状况下,14g CO所含质子数为7NA
C.22g某气体含分子数为0.5NA,则其摩尔质量为44
D.25℃,101KPa条件下,1.4g N2的体积为1.12L
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转
化关系: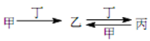 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A、若甲为焦炭,则丁可能是 O2
B、若甲为 SO2,则丁可能是氨水
C、若甲为 Fe,则丁可能是盐酸
D、若甲为 NaOH 溶液,则丁可能是 CO2
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期9月月考化学试卷(解析版) 题型:实验题
(16分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)第一步:将已去除表面氧化物的铁钉(含少量碳元素)放入冷浓硫酸中,第二步:10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面 (填写第二步的实验现象,若有则写出具体现象,若无则写无明显变化),其原因是___________ ______。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热充分反应后得到溶液X并收集到气体Y。
① 甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中有Fe2+,应先用________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KMnO4溶液 d.浓氨水
铁粉与溶液X反应可制得一种补血剂, 写出其离子方程式 。
② 乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,
然后加入足量 BaCl2溶液,经适当操作后得到干燥固体2.33g。由此推知气体Y中SO2的体积分数为__________________。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是____________。
(4)认为气体Y中还含有Q的理由是__________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于__________(填序号)。
a.A之前 b. A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_________________ __
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高一上抽考化学试卷(解析版) 题型:实验题
用 18 mol/L 的浓硫酸配制 100 mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL , 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。 A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的具体操作是_____________________________________
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至___________为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ______________;
②容量瓶用蒸馏水洗涤后残留有少量的水_________________;
③在转入容量瓶前烧杯中溶液未冷却至室温_________;
④加水超过刻度线后, 用胶头滴管吸出多余的液体___________。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:填空题
(10分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中的位置______________________。
(2)实验室制取X元素的氢化物的化学方程式为___________________________。
(3)W、Z的最高价氧化物对应的含氧酸的酸性____________>____________(用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为_________________。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%.该化合物的化学式为_____________________________。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
茶叶中铁元素的检验可经过以下四步骤完成,各步骤中选用的实验用品正确且完整的是

A.将茶叶灼烧灰化,选用①、②
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤
D.检验滤液中的Fe3+,选用③、⑧、⑩
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省许昌、襄城、长葛三校高一上期中测试化学试卷(解析版) 题型:选择题
常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br-,
②2Br-+Cl2=Br2+2Cl-,③2Fe3++2I-=2Fe2++I2。
由此判断下列说法正确的是
A.铁元素在反应①和③中均被氧化
B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化
C.氧化性强弱顺序:Cl2>Br2>I2> Fe3+
D.还原性强弱顺序:I-> Br->Fe2+>Cl-
查看答案和解析>>
科目:高中化学 来源:2016届湖北省老河口市高三上学期期中测试化学试卷(解析版) 题型:选择题
将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com