

��.(1)ʵ�鿪ʼʱ�ȴ���K����ͨ��N2һ��ʱ�����K����ͭ˿(����)��������Ũ������д����ĺ���ɫ�������ɣ���ʱ��Ľ��У�������ɫ��dz����A�г�����ɫ����ʱ��
��װ��A�з�Ӧ�����ӷ���ʽΪ___________________________��
�ڽ�������ʵ�������___________________________________��
(2)��ʵ����װ��A���ŵ���____________________________��
��.��B��������Һϡ����200 mL����0.20 mol/L��NaOH��Һ���еζ���ʵ����������(����Ļӷ��ֽ⼰��Һ����ı仯���Բ���)��
ʵ���� | ����Һ���(mL) | NaOH��Һ���(mL) |
1 | 20.00 | 15.98 |
2 | 20.00 | 14.99 |
3 | 20.00 | 15.01 |
(1)����Һ��Ũ��Ϊ____________mol/L��
(2)������ͭ��Ӧ��Ҫ����NOʱ�����Ũ�Ȳ�����____________mol/L��
��.(1)��3Cu+8H++2![]()
![]() 3Cu2++2NO��+4H2O
3Cu2++2NO��+4H2O
�ڽ�ͭ˿�������뿪Һ�棬��K��ͨ��N2һ��ʱ��
(2)����ʹͭ������ķ�Ӧ��ʱ��ʼ����ʱֹͣ
��.(1)0.15 (2)8
��������.��A�г�����ɫ����ʱ�������ѱ��ϡHNO3����Ӧ�����ӷ���ʽΪ3Cu+8H++2![]()
![]() 2Cu2++2NO��+4H2O���������IJ���Ӧ��ֹͣ��
2Cu2++2NO��+4H2O���������IJ���Ӧ��ֹͣ��
Ӧ���ɽ�ͭ˿�������뿪Һ�棬��K��ͨ��N2һ��ʱ�����ų�װ���е�NO���塣
��.(1)c(HNO3)=![]() =
=![]() =0.15 mol��L-1��
=0.15 mol��L-1��
(2)B������HNO3��0.15 mol��L-1��
3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
0.045 mol 0.03 mol
Cu+4HNO3![]() Cu(NO3)2+2NO2+2H2O
Cu(NO3)2+2NO2+2H2O
0.09 mol 0.045 mol
ʣ��HNO3Ũ��Ϊ![]() =8 mol��L-1������������ͭ��Ӧ��Ҫ����NOʱ�����Ũ�Ȳ�����8 mol��L-1��
=8 mol��L-1������������ͭ��Ӧ��Ҫ����NOʱ�����Ũ�Ȳ�����8 mol��L-1��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
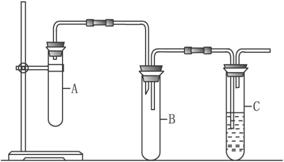
��ش��������⡣
(1)Ϊ�˼�������װ�õ������ԣ�ijͬѧ��������ĩ�˲���ʢˮ���ձ��У���˫������װ��A�д��Թܣ�����������˵��װ���Ƿ��ܱա���ش���μ��װ�������ԣ�______________��
(2)��װ��A�д��Թ����ȼ���1��2���������NaOH���Ҵ���Һ���ټ���___________��Ŀ����__________________________________������װ��C���Թ����������ϡ��ˮ��
(3)��װ��A�д��Թ������ӵij������ܵ������� _________________________________��װ��B�������� ____________________________________________________________��
(4)֤��1��2���������ѷ�����ȥ��Ӧ��������_______________________________________������ͨ��ʲôʵ�������֤��________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�����ʡ�人��������������µ��в������ۻ�ѧ���� ���ͣ������
��15�֣���������ҩƬ���������һ�����ʵ����£���һ����������ƶѪ��ҩ����ij��ѧ����С��Ϊ�ⶨ�������������ĺ�������������ʵ�飺
I����ͬѧҪ�ⶨ������Ԫ�غ�����ʵ�鰴���²�����У�
������������̣��ش��������⣺
��1���γ�ҩƬ�����£���ͬѧ���³Ƶ���Ʒag��������Ϊa=�ߣߣߣߣߡ�
��2�����������Ѹ���ܽ⣬����250mL��Һ��������Һʱ���ձ�������������Ͳ��250mL����ƿ�⣬�������еIJ��������ߣߣߣߣߣߣߣߣߣߡ�
��3��ϴ�ӳ����IJ����ǣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
��4������������ȣ���ȴ�����£�����ƽ����������Ϊb1g���ٴμ��Ȳ���ȴ�����³���������Ϊb2g����b1-b2=0.3g���ݴ˽������Ӧ���еIJ����ǣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
���ݲ�õ����ݿɼ�������������ĺ�����
II����ͬѧ���ݷ�Ӧ��2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O�����õζ��ķ����ⶨ������������������������
��5��ȡ������ͬѧ�����õĴ���Һ25.00mL������ƿ�У�����0.02mol/L KMnO4�ı���Һװ��ߣߣߣߣߣ�����ʽ����ʽ�����ζ����У�����Һ������0���̶ȡ�
��6���ζ�����ʱ���۾�ע�ӣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
��7���ζ�����Һ���յ㣬��˵ζ����Σ�ʵ���������±���ʾ��
�����е�һ�εζ��������������ͼ����������õ�����������У�
��Ʒ��������������������Ϊ�ߣߣߣߣߡ�������3λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ�߶���ѧ����ĩ���Ի�ѧ���⣨ѡ�ޣ� ���ͣ�ʵ����
��֪1��2-�������鳣����Ϊ��ɫҺ�壬�е�Ϊ83.5 �棬�ܶ�Ϊ1.23 g��mL-1��������ˮ�������ڴ����ѡ���ͪ���л��ܼ����Ҵ��ķе�Ϊ78.5 �档ij��ѧ����С��Ϊ̽��1��2-�����������ȥ��Ӧ���������ͼ��ʾ��ʵ��װ�ã�����װ����ȥ����
��1����ͼ��ʾ�����Ӻ�����װ��֮����������еIJ����� ��
��2�� ��װ��A�д��Թ��м���1��2��������� (д����)������װ��C���Թ������������ˮ��A�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��3����װ��A�д��Թ������ӵij������ܳ�������������� __________________��װ��B�������� _________________��
��4��֤��1��2-���������ѷ�����ȥ��Ӧ��������_______________������ͨ��ʲôʵ�������֤��________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com