
【题目】电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(OH)能氧化降解有机污染物。下列说法错误的是
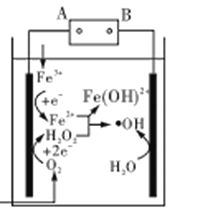
A.电源的A极为负极
B.每消耗2. 24 LO2(标准状况),整个电解池中理论上可产生的OH为0.2 mol
C.与电源B极相连电极的电极反应式为:H2O-e-=H++﹒OH
D.H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++﹒OH
【答案】B
【解析】
由反应原理图可知,Fe3+在左端电极得电子生成Fe2+,发生还原反应,左端电极为阴极,则A为电源的负极,B为电源的正极。
A.由以上分析知,A极为电源的负极,A正确;
B.每消耗0.1molO2,在阴极共得到0.3mole-,生成0.1molOH,同时阳极失去0.3mole-,生成0.3molOH,所以共生成OH为0.4 mol,B不正确;
C.与电源B极相连的电极为阳极,水在阳极上失电子生成OH,电极反应式为:H2O-e-=H++OH,C正确;
D.电解产生的H2O2与Fe2+发生反应,生成OH和Fe(OH)2+,反应方程式为:H2O2+Fe2+=Fe(OH)2++OH,D正确;
故选B。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列装置不能完成相应实验的是
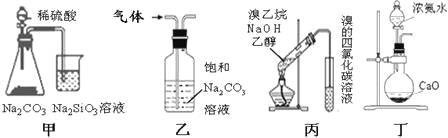
A.甲装置可比较硫、碳、硅三种元素的非金属性强弱
B.乙装置可除去CO2中少量的SO2杂质
C.丙装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
D.丁装置可用于实验室制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:反应中除了生成NO2气体外还会有少量的NO生成;常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计如下实验:
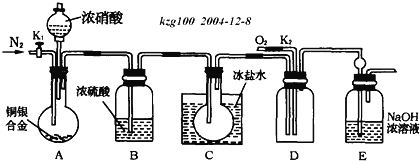
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___。
(2)装置B瓶的作用是___。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是___;实验发现,通入氧气温度的高低对实验现象有较大影响,则为便于观察应通入___(填“冷”或“热”)的氧气。
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___。
(5)实验测得下列数据:所用铜银合金质量:15.0g、浓硝酸:40mL13.5mol/L;实验后A中溶液体积:40mL;H+浓度:1.0mol/L。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为___。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需要测定的数据是___。
(6)若实验只测定 Cu的质量分数,不验证NO的产生,则在铜银合金中与浓硝酸反应后,只需要简单的实验操作可达到目的,请简述实验过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
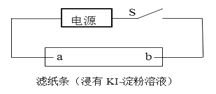
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应I: Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
反应Ⅱ:Al2O3(s)+3C(s) =2Al(g)+3CO(g) ΔH2=bkJ·mol-1
反应Ⅲ:3AlCl(g)=2Al(l)+AlCl3(g) ΔH3
①反应Ⅲ的△H3=____kJ/mol。
②950℃时,铝土矿(Al2O3)与足量的焦炭和C12反应可制得AlCl3。该反应的化学方程式是 _____________________________
(2)在高温条件下进行反应:2Al(l)+AlCl3 (g)![]() 3AlCl(g)
3AlCl(g)
①向图1所示的起始容积相等的两个密闭容器A、B中加入足量的Al粉,再分别充入1molAICl3 (g),在相同的高温下进行反应。图2表示A容器内的AlC13(g)体积分数随时间的变化图,在图2中画出 B容器内AlCl3 (g)体积分数随时间的变化曲线____________。
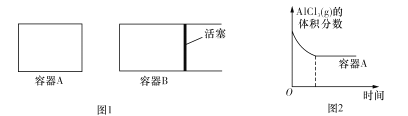
②1 100℃时,向2L密闭容器中通入3mol AlCl(g),发生反应:3AlCl(g)![]() 2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
③加入3 mol AlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。则此反应选择温度为 _____________________
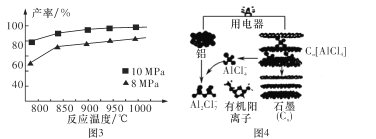
(3)铝可以用来制作快速放电铝离子二次电池,该电池以金属铝和石墨为电极,用AlCl4-、Al2Cl2-和有机阳离子组成电解质溶液,其工作原理如图4所示。
①该电池放电时,AlCl4-向 ___(填“铝电极”或“石墨电极”)方向移动。
②该电池充电时,阴极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铝的第一电离能比镁的第一电离能大
B.同一主族元素从上到下电负性逐渐变大
C.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.最外层电子数是核外电子总数![]() 的原子和最外层电子排布式为4s24p5的原子是同种元素原子
的原子和最外层电子排布式为4s24p5的原子是同种元素原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为___。
![]() 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
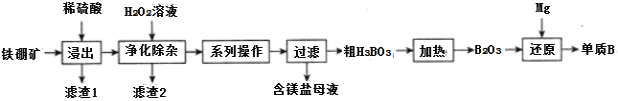
已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的PH | 2.7 | 3.1 |
沉淀完全的PH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为___。
“浸出”时,将铁硼矿石粉碎的目的为___。
![]() 滤渣1的主要成分为___。
滤渣1的主要成分为___。
![]() “净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
“净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com