
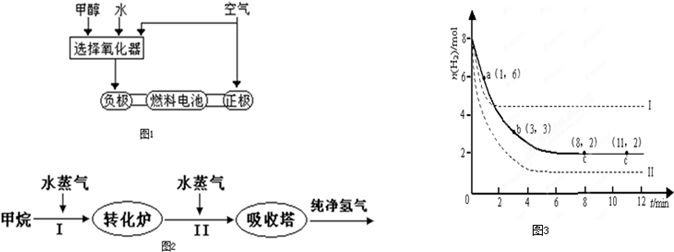
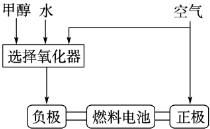
(10分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如右图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
|
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为 。
(2)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
|
实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
0.5 |
2 |
1 |
1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
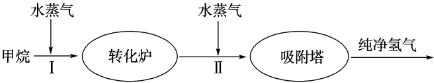
(4)右图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是(写出两种) 。

(1) (1分) 放(1分) 50%(2分)
(1分) 放(1分) 50%(2分)
(2)B(2分)
(3)④⑤⑥(2分)
(4)降低温度,或增加水蒸汽的量,或减少氢气的量(2分)
【解析】(1)分析表格数据,得:升温K值减小,即平衡逆向移动,说明逆向是吸热反应,则正向为放热反应;
830℃ CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
n0 1mo1 1mo1 0 0
n x x x x
n(平衡)1-x 1-x x x
则K=x2/(1-x)2=1,求解,得:x=0.5 mo1
所以,达到平衡后CO的转化率=x/1mo1=50%;
(2)利用Q与K的关系求解;利用Q=[C(H2)C(CO2)]/[C(CO)C(H2O)],依次求得Q(A)=1.2、Q(B)=0.25、Q(C)=1;要正向进行,则Q<K,故选B;
(3)因反应前后气态物质系数相等,则无论是否达平衡态,压强都不变,故①不是反应达到平衡的标志;②混合气体的密度=m(气体)/V,因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,“固定容积的容器”则V为一定值,故②不是反应达到平衡的标志;③混合气体的平均相对分子质量= m(气体)/n(气体),因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,由化学方程式系数得:无论是否达平衡态,n(气体)为一定值,故③不是反应达到平衡的标志;④是;⑤该反应为放热反应,则体系的温度不变,说明达到了平衡态;⑥是;
(4)分析图像可以看出:在t2时刻,因条件的改变使C(CO2)增大、C(CO)减小,说明平衡正向移动;但不能是增大C(CO)使平衡正向移动(因增大C(CO),能使平衡正向移动,C(CO2)增大,但C(CO)也增大)


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:阅读理解
 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 高温 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
(1)此流程的第II步反应为:CO(g)+H2O(g)H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[来源:] |
| B | 0、0、2、2 | c2 | Q2 | α2
|
| C | 2、2、0、0 | c3 | Q3 | α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、
(写出两种)。若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(9分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如
下图:
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与HzO均为1 mo1,则达到平衡后CO的转化率为_____。
(2)此流程的第II步反应CO(g)+H2O(g) H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是
① 体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④ 各组分的物质的量浓度不再改变 ⑤ 体系的温度不再发生变化 ⑥ v(CO2正)= v(H2O逆)
(4) 图表示该反应此流程的第II步反应在时刻t![]() 达到平衡、在时刻t
达到平衡、在时刻t![]() 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t![]() 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为 33.2(单位为kJ),第Ⅰ步反应的热化学方程式为: CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com