
| A. | 夏天的食物比冬天的食物腐败变质更快 | |
| B. | 锅炉房里粉末状的煤比块状的煤燃烧得更快更旺 | |
| C. | 汽车加大油门跑得更快 | |
| D. | 充满N2的塑料密封袋保存的薯片保质期更长 |
分析 影响化学反应速率的外界因素有温度、浓度、表面积以及催化剂等,一般来说,增大浓度、升高温度,增大固体表面积以及加入催化剂都可增大反应速率,结合题给信息解答该题.
解答 解:A.夏天温度高,反应速率较大,食物腐败变质更快,故A选;
B.增大固体表面积,可增大反应速率,与温度无关,故B不选;
C.汽车加大油门,增大反应物浓度,反应速率增大,与温度无关,故C不选;
D.充满N2的塑料密封袋可隔绝空气,防护食品被氧化,与温度无关,故D不选.
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点和常见题型,题目侧重于化学与生活的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | 高温下用焦炭还原SiO2制取粗硅 | |
| C. | 用硫酸清洗锅炉中的水垢 | |
| D. | 用Na2S作沉淀剂,出去沸水中过的Hg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的PH不变 | B. | 溶液中氢氧化钙的质量分数增大 | ||
| C. | 溶液中钙离子浓度变大 | D. | 溶液中钙离子的物质的量减少. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3molHNO3 | B. | 0.1mol H3PO4 | ||
| C. | 0.2molCH4 | D. | 3.612×1023个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的负极发生氧化反应,原电池在工作时负极一定溶解 | |
| B. | 以KOH溶液为电解质溶液的甲烷燃料电池工作时,OH-离子从正极移向负极,电解质溶液的PH增大 | |
| C. | 以两个铜棒为电极电解硫酸溶液,在阴极上发生还原反应,且始终是H+在阴极放电生成H2 | |
| D. | 反应2Ag+2HCl═2AgCl+H2↑在电解的条件下可以发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 解释 |
| A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
| C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子且苯与水不互溶 |
| D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、Fe2+、SO42-、Cl-可以大量共存 | |
| B. | 向该溶液中通入SO2气体不会发生反应 | |
| C. | 向该溶液中加入过量氨水发生反应的离子方程式Al3++4NH3•H2O═AlO2-+4NH4++2H2O: | |
| D. | 向该溶液中滴入Na2CO3溶液发生反应的离子方程式:2Al3++3CO32-+3 H2O═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的电子式: | |
| B. | 质子数为94、中子数为145的钚(Pu)原子:${\;}_{94}^{145}$Pu | |
| C. | 氯离子的结构示意图: | |
| D. | 对二甲苯的结构简式: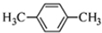 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com