
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡过程体系 | |||
| CO | H2O | CO2 | H2 | 能量的变化 | |
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
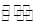 CO2(g)+H2(g) △H<0。
CO2(g)+H2(g) △H<0。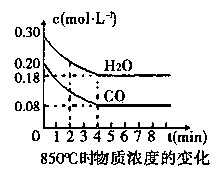
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
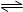 2SO3(g) + 197 kJ实验测得有关数据如下:
2SO3(g) + 197 kJ实验测得有关数据如下:| 容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/KJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色| A.NaHSO4 | B.NaHCO3 | C.Na2CO3 | D.CH3COONa |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 P(g) + 2L。在不同的条件下P的百分含量P%的变化情况如图,则反应
P(g) + 2L。在不同的条件下P的百分含量P%的变化情况如图,则反应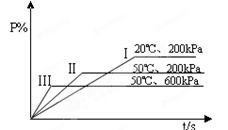
| A.正反应放热,L是固体 | B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 | D.正反应放热,L是固体或气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: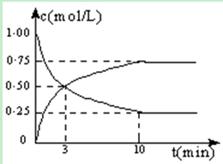
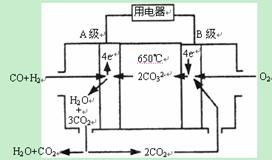
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com