
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有SO32-时,用HNO3酸化后再加BaCl2溶液
B.为提高KMnO4溶液的氧化能力,用盐酸酸化KMnO4溶液
C.检验某溶液是否含有Fe3+时,用HNO3酸化后,加KSCN溶液
D.检验溶液中是否含有SO42-时,用HCl酸化后,加BaCl2溶液
科目:高中化学 来源:2014--2015学年北京市高一上学期期中练习化学试卷(解析版) 题型:填空题
[第(1)(3)(4)(6)问每空1分;(2)(5)每空2分,共13分]
粗食盐中常含有少量Ca2+、Mg2+、SO42-以及泥沙等杂质,实验室提纯NaCl的流程如下(加入的试剂稍过量)
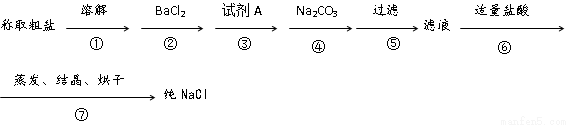
(1)步骤③中加入的试剂A是 (填化学式),其目的是 。
(2)第⑥步中,写出相应的离子方程式 。
(3)步骤⑤和⑥之间,若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是 。
(4)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,其中过滤时,使用玻璃棒的目的是 。
(5)用上述方法获得的氯化钠去配制200mL0.1mol/LNaCl溶液。
①用托盘天平称氯化钠固体的质量是 g
②配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
③下列操作中,可能造成所配制溶液的浓度偏低的是 。
A、没有洗涤烧杯和玻璃棒
B、定容时,仰视刻度线读数
C、定容时,俯视刻度线读数
D、洗涤后的容量瓶中残留少量蒸馏水
(6)此方法获得的氯化钠溶液的导电性远远强于氯化钠固体,是因为氯化钠固体在水分子的作用下,电离成自由移动的离子,请写出相关的电离方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013~2014学年福建省第一学期高三第二次月考化学试卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
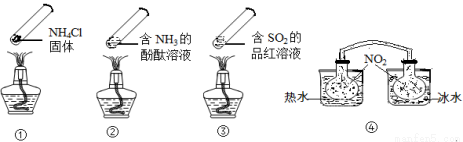
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
将13.0g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标况)。另取等质量的合金溶于过量的稀硝酸中生成6.72L(标况)NO,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量是
A.11.85g B.12.7g C.27.45 g D.28.3g
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在熔化状态下能导电的化合物为离子化合物
B.根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
C.CO2、SiO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
D.因为Na2O的水溶液能导电,所以Na2O是电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②HCl NaAlO2 NaCl
③NaHCO3 Ba(OH)2 H2SO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.①③ C.①②③ D.①②④
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省鞍山市高一下学期期末考试化学(A卷)试卷(解析版) 题型:填空题
(11分)地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图,请根据该图回答下列问题:

(1)淡化海水的方法有__________________(写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO2-4等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________(填化学式),之后________(填操作名称),再加入适量________(填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)反应④由无水MgCl2制取金属镁的常用工业方法是__________________。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_________________________。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的离子方程式__________________________________。最后再用H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省鞍山市高一下学期期末考试化学(A卷)试卷(解析版) 题型:选择题
下列化合物中,既含有离子键又含有共价键的是
A.BaCl2B.H2OC.Ca(OH)2D.Na2O
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州八市高一下学期期中考试化学试卷(解析版) 题型:选择题
可用如图装置制取(必要时可加热)、净化、收集的气体是( )
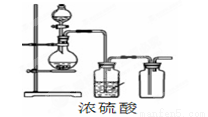
A.铜和稀硝酸制一氧化氮 B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气 D.硫化亚铁与稀硫酸制硫化氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com