在反应MnO2+4HCl=MnCl2+Cl2+2H2O中,氧化剂是:________,还原剂是:________,被氧化的物质是:________,发生还原反应的物质是:________.氧化产物是________,还原产物是:________当有0.5mol的Cl2生成时,反应中转移的电子数是:________.
MnO2 HCl HCl MnO2 Cl2 MnCl2 NA
分析:根据化合价的变化判断氧化剂、还原剂以及反应类型、反应产物,由氯气与转移电子的关系式计算转移电子数.
解答:MnO2+4HCl=MnCl2+Cl2+2H2O,该反应中元素的化合价变化为:MnO2→MnCl2,Mn元素由+4价→+2价,得电子,所以MnO2氧化剂,氧化剂被还原发生还原反应,其对应的产物MnCl2是还原产物;HCl→Cl2,Cl元素由-1价→0价,失电子,所以HCl是还原剂,还原剂被氧化发生氧化反应,其对应的产物Cl2是氧化产物.
MnO2+4HCl=MnCl2+Cl2+2H2O 转移电子
1mol 2 NA
0.5mol NA
故答案为:MnO2;HCl;HCl;MnO2;Cl2;MnCl2;NA.
点评:本题考查了氧化还原反应中氧化剂、还原剂、氧化产物、还原产物等概念及物质的量的有关计算,侧重考查学生对概念的辨别能力,要注意本题中HCl不仅作还原剂还作酸.




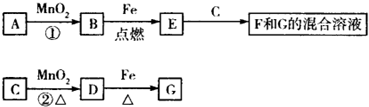
 (2012?大连模拟)已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按所示框图进行反应.
(2012?大连模拟)已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按所示框图进行反应.