
| 0.14CV |
| m |
| 14CV |
| m |
| 0.14CV |
| m |
| 14CV |
| m |


科目:高中化学 来源: 题型:阅读理解
| 0.14CV |
| m |
| 14CV |
| m |
| 0.14CV |
| m |
| 14CV |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
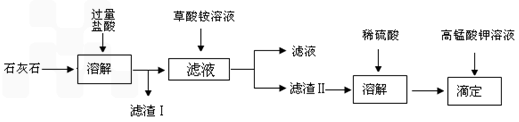
石灰石的主要成份是碳酸钙,含氧化钙约 40~50% ,较好的石灰石含 CaO 约 45~53% 。此外还有 SiO2 、 Fe2O3 、 Al2O3 及 MgO 等杂质。测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC2O4?H2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量。 涉及的化学反应为:
H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)
CaC2O4 沉淀颗粒细小,易沾污,难于过滤。为了得到纯净而粗大的结晶,通常在含 Ca2+的酸性溶液中加入饱和 (NH4)2C2O4 ,由于 C2O42- 浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中 C2O42- 浓度慢慢增大,可以获得颗粒比较粗大的 CaC2O4 沉淀。沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使 CaC2O4 溶解度太大。
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
(4)写出硫酸溶解草酸钙沉淀的离子方程式:
(5)若开始用去m g样品,最后滴定用去浓度为C mol/L 的KMnO4 溶液 v ml,推出CaO含量与 KMnO4的定量计算关系。ω%=
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com