
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A.“某物质 ”具有还原性
”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
D.CuH与足量稀硝酸反应:CuH+3H++NO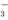 =Cu2++NO↑+2H2O
=Cu2++NO↑+2H2O
科目:高中化学 来源:2017届广东省高三上第二次段考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.2.0g D2O中含有的质子数、中子数均为NA
B.标准状况下,22.4 L CCl4含有NA个CCl4分子
C.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
D.一定条件下1 mol N2和3 mol H2充分反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A.生铁片发生吸氧腐蚀
B.中心区:Fe–2e—==Fe2+
C.边缘处:O2+2H2O+4e—==4OH—
D.交界处:4Fe2++O2+10H2O==4Fe(OH)3+8H+
查看答案和解析>>
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:选择题
一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )
A.充电时阴极发生氧化反应
B.充电时将碳电极与电源的正极相连
C.放电时碳电极反应为原电池的负极
D.放电时镍电极反应为Ni(OH)2-e-+OH-=NiO(OH)+H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:填空题
按要求完成下列空白:
⑴印刷电路板是由高分子材料和铜箔复合而成.刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的离子方程式 。
⑵请写出在碱性溶液中,ClO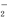 与Fe2+反应的离子方程式为: 。
与Fe2+反应的离子方程式为: 。
⑶NaAlH4是重要的还原剂。请写出NaAlH4与水发生氧化还原反应的化学方程式: 。
⑷+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,请写出该反应的离子方程式: 。
⑸亚氯酸钠(NaClO2)溶液可作为烟气的吸收剂,并对烟气进行脱硫、脱硝。在装有亚氯酸钠溶液的鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10?3mol·L?1。反应一段时间后溶液中离子浓度的分析结果如下表。
离 | SO | SO | NO | NO | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
写出NaClO2溶液脱硝过程中主要反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
下列叙述中正确的是 ( )
A.氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3·H2O===Al(OH)3↓+3NH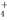
B.在加入铝粉能放出氢气的溶液中,K+、NH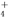 、CO
、CO 、Cl-一定能够大量共存
、Cl-一定能够大量共存
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO  3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
下列有关金属的说法中,正确的是( )
①纯铁不容易生锈;②钠着火用水扑灭;③铝在空气中耐腐蚀,所以铝是不活泼金属;④缺钙会引起骨质疏松,缺铁会引起贫血;⑤青铜、不锈钢、硬铝都是合金;⑥KSCN溶液可以检验Fe3+
A.①④⑤⑥ B.②③④⑤ C.①③④⑤ D .①②⑤⑥
.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:填空题
合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
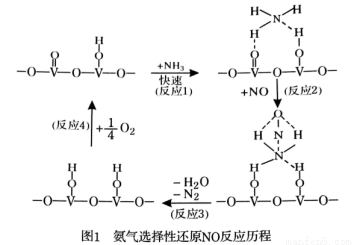
写出总反应化学方程式 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
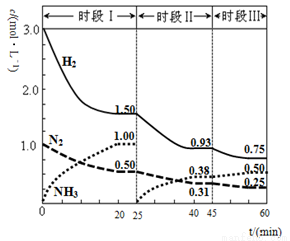
在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
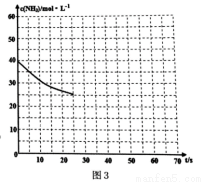
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2017届山东省潍坊市临朐县高三12月阶段测化学试卷(解析版) 题型:填空题
硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。
⑴利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+1/2O2(g) SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
①该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _________ v (逆)(填“<”、“>”或“=”)。
(逆)(填“<”、“>”或“=”)。
②该温度下,向一体积为2 L的恒容密闭容器中充入2.0 mol SO2和1.0 molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为_______________。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__________(填字母)。
A.保持 温度和容器体积不变,充入1.0 mol O2
温度和容器体积不变,充入1.0 mol O2
B.升高温度
C.保持温度和容器体积不变,充入1.0  mol SO3
mol SO3
D.增大容器体积
⑵室温下,Li /FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是___________________。
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产生物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等,请写出化学反应方程式:第一次放电:__________________;第二次放电:________________。
⑶制取高纯度黄铁矿的另一种方法是:以LiCl—KCl低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解,写出阳极方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com