
(1)已知胆矾失水的化学反应方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)=Cu2+(aq)+SO42﹣(aq);△H=﹣Q2kJ/mol
(3)胆矾溶于水时,溶液温度降低.Q1与Q2的关系是(Q1、Q2为正数)( )
|
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
| 反应热和焓变. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | 已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol;CuSO4(s)=Cu2+(aq)+SO42﹣(aq);△H=﹣Q2kJ/mol; 胆矾溶于水时,溶液温度降低,反应为CuSO4•5H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l)△H′>0;根据盖斯定律确定△H′与Q1、Q2的关系. |
| 解答: | 解:已知①CuSO4•5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol; ②CuSO4(s)=Cu2+(aq)+SO42﹣(aq);△H=﹣Q2kJ/mol; ③CuSO4•5H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l)△H′>0; 根据盖斯定律:方程③=方程①+方程②, 所以△H′=Q1+(﹣Q2)>0,即Q1>Q2, 故选A. |
| 点评: | 本题考查了物质溶解恒容物质分解过程中的能量变化,根据盖斯定律分析物质溶解过程中的能量变化是解题关键,题目难度中等. |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和
5.4 mol·L-1,在一定条件下它们反应生成NH3,10 min后测得N2的浓度是
0.8 mol·L-1,则在这10 min内NH3的平均反应速率是( )
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
配制500mL 0.5mol•L﹣1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 g .
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放的标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将 (填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为 .假定最终称得小烧杯的质量为 (填“32.6g”或“32.61 g”).
(3)配制方法:设计五个操作步骤
①向盛有NaOH的烧杯中加入200 mL 蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1 cm~2 cm.
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作按正确顺序编出序号 .
(4)某学生实际配制NaOH溶液的浓度0.48mol•L﹣1,原因可能是
A. 使用滤纸称量氢氧化钠固体 B. 容量瓶中原来存有少量蒸馏水
C. 溶解后的烧杯未经多次洗涤 D.定容时仰视刻度.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质进行一氯取代反应后,只能生成四种沸点不同产物的烃是( )
|
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 |
|
| C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a g•cm﹣3.RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中.
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应.
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀.
④将沉淀过滤、洗涤、干燥后称重,得到固体c g.
回答下列问题:
(1)装置中长玻璃管的作用是 .
(2)该卤代烷中所含卤素的名称是 ,判断依据是 .
(3)如R为乙基,则RX与KOH醇溶液反应的方程式为:
(4)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值
A.偏大 B.偏小 C.不变 D.大小不定.
查看答案和解析>>
科目:高中化学 来源: 题型:
足量镁粉与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但并不影响氢气产生的总量,可以加入下列物质中的( )
|
| A. | MgO | B. | NaOH | C. | K2CO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
|
| B. | 电池负极的电极反应式为Zn﹣2e﹣+2 OH﹣=Zn(OH)2 |
|
| C. | 电池工作时,电流由正极通过外电路流向负极 |
|
| D. | 碱性锌锰电池是二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
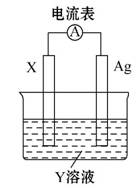
A.电解质溶液Y是CuSO4溶液
B.电极X的材料是Cu
C.银电极为电池的正极,其电极反应为Ag++e-====Ag
D.外电路中的电子是从X电极流向Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A.7.8g过氧化钠含有的共用电子对数为0.2NA
B.2H2O2(l)=2H2O(l)+O2(g) ΔH=−98.2 kJ·mol−1,ΔS=70.5 J·mol−1·K−1,该反应低温能自发进行
C.过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D.在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com