

分析 灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O,Na2MoO4与足量盐酸反应生成钼酸,高温灼烧钼酸生成MoO3,氢气还原MoO3得到Mo,
(1)焙烧时MoS2发生氧化反应生成MoO3;生成的二氧化硫形成酸雨危害环境;
(2)根据据钼酸钡和硫酸钡的溶度积计算出溶液中硫酸根离子的浓度,再计算出SO42-的去除率;
(3)①根据元素守恒分析;
②MoS2与MoO3反应生成MoO2和SO2的反应,根据质量守恒和电子转移分析可得;
(4)充电时阳极发生氧化反应.
解答 解:(1)焙烧时MoS2发生氧化反应生成MoO3同时生成二氧化硫:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2;其中SO2形成酸雨危害环境;
故答案为:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2;SO2;形成酸雨;
(2)c(MoO42-)=0.80mol•L-1,c(SO42-)=0.04mol•L-1,当BaMoO4开始沉淀时,c(Ba2+)=$\frac{Ksp(BaMo{O}_{4})}{c(Mo{{O}_{4}}^{2-})}$=$\frac{4.0×1{0}^{-8}}{0.80}$mol/L=5.0×10-8mol•L-1,
此时c(SO42-)=$\frac{1.1×1{0}^{-10}}{5.0×1{0}^{-8}}$mol/L=2.2×10-3mol•L-1,
SO42-的去除率=$\frac{0.040-2.2×1{0}^{-3}}{0.040}$×100%=94.5%;
故答案为:94.5%;
(3)①由图2可知,6层中存在的固体物质分别为MoS2、MoO3、MoO2,图象分析MoS2、MoO3的物质的量百分比均为18%,根据Mo元素守恒,则MoO2 的物质的量百分比为64%,则x为64;
故答案为:64;
②MoS2与MoO3反应生成MoO2和SO2,反应为:MoS2+6MoO3$\frac{\underline{\;高温\;}}{\;}$7MoO2+2SO2,其中MoS2中Mo元素化合价不变,S元素由-4升高到+4价,被氧化,MoO3中Mo元素化合价由+6价降低到+4价,作氧化剂,6mol氧化剂MoO3反应转移电子12mol,故若该反应转移6mol电子,消耗的MoO33mol;
故答案为:MoS2+6MoO3$\frac{\underline{\;高温\;}}{\;}$7MoO2+2SO2;MoO3;3;
(4)充电时,阳极失去电子发生氧化反应,故反应式为:MgxMo3S4-2xe-=Mo3S4+xMg2+或MoS42x--2xe-=Mo3S4;
故答案为:MgxMo3S4-2xe-=Mo3S4+xMg2+或MoS42x--2xe-=Mo3S4.
点评 本题考查混合物的分离和提纯,为高频考点,侧重考查流程图中操作过程、物质性质、图象分析、电化学原理等,明确操作基本原理及物质的性质是解本题关键,同时考查学生分析判断及知识综合应用能力,难点是溶度积常数的有关计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. |  利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. |  制备Fe(OH)2:用图所示装置,向试管中加入NaOH溶液,振荡 | |
| D. |  用图装置测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4含有的分子数目为0.5NA | |
| B. | 将10mL 1 mol/L FeCl3溶浪滴入沸水中,所得氢氧化铁胶粒数为0.01NA | |
| C. | 1 mol/LNa2O2固体中含离子总数为3NA | |
| D. | 0.1moIH2O和D2O组成的混合物中含有中子数是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
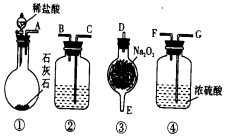 实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 | |
| B. | 少数商贩在蔬菜表面洒福尔马林,用于食品保鲜 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 某新型航天服材料主要成分是碳化硅陶瓷和碳纤维复合而成,是一种新型复合材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.5 mol•L-1 MgCl2溶液 | B. | 200mL 0.25 mol•L-1 AlCl3溶液 | ||
| C. | 50ml 1 mol•L-1 NaCl溶液 | D. | 25ml 0.25 mol•L-1 CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com