
 在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )| A、平衡时N的转化率为50% |
| B、当温度升高后,则图中θ>450 |
| C、若再加入N,则正、逆反应速率均逐渐增大 |
| D、若在加入N,则反应体系中气体密度减小 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
| m |
| V |
| 0.25nMM+nMN |
| (0.5n+0.25n)Vm |
| 0.25MM+MN |
| 0.75Vm |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
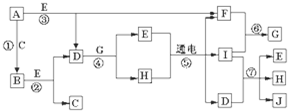
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| B、25℃时,pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
| C、用惰性电极电解NaOH、H2SO4、Ba(OH)2中任意一种的溶液时只生成氢气和氧气 |
| D、在水电离出的H+浓度为1×10-12 mol/L的溶液中,K+、NO3-、I-一定能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 373 | 473 | 573 | 673 | 773 |
| K | 3.35×109 | 1.00×107 | 2.45×105 | 1.88×104 | 2.99×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向正极移动 |
| C、充电时每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D、电池充电过程中,KOH的物质的量浓度将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、纯铝制品在空气中表面逐渐失去金属光泽 |
| C、锌与稀硫酸反应时,往溶液中滴入几滴CuSO4溶液可以使反应变快 |
| D、与电源的负极相连的金属不易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3+2KI+H2O═2KOH+I2+O2 | ||||
| B、3NO2+H2O═2HNO3+NO | ||||
| C、3S+6NaOH═Na2SO3+2Na2S+3H2O | ||||
D、4HCl(浓)+MnO2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaH是离子化合物,则NaH的电子式为Na:H |
| B、碘-131是一种放射性元素,其简单阴离子的核外电子数为53 |
| C、等物质的量的HCl和NaCl中分子数相等 |
| D、核素A与核素B的质量数相等,中子数不相等,它们一定不是同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com