
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:阅读理解
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温高压 |
| ||
| ||
| 高温高压 |
| ||
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省三校高三上学期12月联考理综化学试卷(解析版) 题型:填空题
固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3 2KNO2+O2↑
2KNO2+O2↑
II.2Cu(NO3)
2  2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
III.2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6。 (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为 。
②若该固体是混合物,则该混合物的可能组成为 。
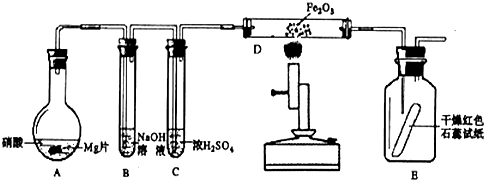
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g 。
①步骤a的目的是 ;
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为: 。
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为 ,用离子方程式表示出现该现象的原因:_____________________ 。
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com