
(8分)可以将氧化还原反应2H2+O2=2H2O设计成原电池。
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_________________________
___________;负极的电极反应式为__________________________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为________________________
_____________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
(1)O2+4H++4eˉ=2H2O(2分);2H2-4eˉ=4H+(2分);
(2)CH4+10OH--8e-=CO32-+7H2O(2分);1(1分);10(1分);
【解析】
试题分析:(1)酸性氢氧燃料电池中,负极上燃料失电子生成氢离子、正极上氧气得电子和氢离子反应生成水,正极反应为O2+4H++4eˉ=2H2O;负极反应为2H2-4eˉ=4H+。
(2)碱性甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成水和碳酸根离子,电极反应为CH4+10OH--8e-=CO32-+7H2O;电池反应式为CH4+2KOH+2O2=K2CO3+3H2O,根据KOH和转移电子之间的关系式得消耗n(KOH)=4mol÷8×2=1mol;甲烷取代反应中,被取代H原子的物质的量与氯气的物质的量相等,生成等物质的量的四种氯代物,则生成四种氯代物的物质的量都是1mol,消耗氯气的物质的量=1mol×(1+2+3+4)=10mol。
考点:本题考查原电池原理及物质的量的计算。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
将KClO3、I2各0.02 mol加入12 g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气。则A的化学式可能是
A.I2Cl6 B.HClO C.IClO D. KIO3
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:填空题
(6分)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
下列反应属于吸热反应的是( )
A.碳与水蒸气制水煤气的反应
B.生石灰和水的反应
C.盐酸与氢氧化钠溶液的反应
D.木炭在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:选择题
根据下列事实,可知X、Y、Z、W还原性由强到弱的顺序是
① X+Y2+=X2++Y ② Z+2H2O=Z(OH)2+H2↑ ③ Z2+比X2+的氧化性弱
④Y元素最高价氧化物对应水化物的碱性比W元素最高价氧化物对应水化物的碱性强
A.X>Z>Y>WB.Z>W>X>Y
C.Z>X>Y>WD.Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:选择题
某单烯烃与H2加成后的产物是: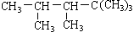 ,则该烯烃的结构式可能有
,则该烯烃的结构式可能有
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:填空题
(7分)请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省眉山市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.25℃时,pH=7的CH3COOH与CH3COONa的混合液中离子浓度的大小顺序为:
c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
B.25℃时,0.1mol/L NaHA溶液pH=3,该溶液中某些微粒的浓度大小顺序为:
c(HA-)>c(H+)>c(H2A)>c(A2-)
C.25℃时,若10mL pH=a的盐酸与100mL pH=b 的Ba(OH)2溶液混合后恰好中和,则a+b=13
D.25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com