
0.01mol·LH2SO4滴定0.01mol·L-1NaOH溶液,中和后加水至100ml.若滴定时终点判断有误差:
①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05ml),则①和②[H+]之比是( )
A.10 B.50 C.5×103 D.104
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
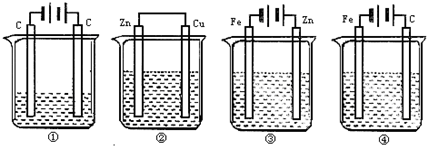
下图中 4种装置①盛 100mLCuSO4,②盛200mL 0.01mol/ LH2SO4,③盛200mL ZnCl2,④盛200mL NaCl饱和溶液工作一段时间后,测得导线上均通过了0.002 mol电子,此时溶液的 pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)
A.④②③①
B.④③①②
C.④③②①
D.④①③②
</PGN0015B.TXT/PGN>
查看答案和解析>>
科目:高中化学 来源:2010年湖北省高二上学期期中考试试题化学 题型:选择题
用0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05ml),则①和
②c(H+)之比是( )
A.10 B.50 C.5×103 D.104
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com