
【题目】下列对分子结构及其性质的解释中,不正确的是
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 乳酸[CH3CH(OH)COOH]属于手性分子,因分子中存在手性碳原子
C. 配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道
D. 酸性H3PO4>HClO,是因为H3PO4分子非羟基氧原子数目比HClO多
【答案】C
【解析】A,根据相似相溶原理,由非极性分子组成的溶质易溶于非极性分子组成的溶剂,而由极性分子组成的溶质则易溶于极性分子组成的溶剂。碘、甲烷和四氯化碳都是非极性分子,而水是极性分子,所以A是正确的。B,乳酸分子中的2号碳原子(即中间的碳原子)上连接了4个不同的原子或原子团,分别为氢原子、甲基、羟基和羧基,所以乳酸分子中的2号碳原子是手性碳原子,B正确。C,因为有些主族元素(如[B(OH)4]-中的B原子)也可以作为中心原子,所以配合物中不一定含有过度金属原子或离子, C不正确。D,磷酸分子中有1个非羟基氧原子,其结构式为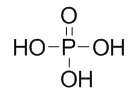 。而次氯酸分子结构式为H-O-Cl,没有非羟基氧原子,一般地,含氧酸分子中非羟基氧原子数目越多,酸性越强,所以D正确。
。而次氯酸分子结构式为H-O-Cl,没有非羟基氧原子,一般地,含氧酸分子中非羟基氧原子数目越多,酸性越强,所以D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质能发生消去反应且产物只有一种的是
A. (CH3)3COH B. CH3OH C. CH3CHICH2CH3 D. (CH3)3C-CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下。下列说法正确的是

A. a电极为太阳能电池的正极
B. 产生丙烯的电极反应式为:3CO2+18H++18e-===CH3CH=CH2+6H2O
C. 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散
D. 太阳能电池的原理与原电池的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)基态锌原子的价电子排布式是_____________。
(2)根据元素周期律,电负性Se______S,第一电离能Se________As(填“>”或“<”)。
(3)H2Se的分子构型是___________,其中Se的杂化轨道类型是___________。
(4)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(5)晶体Zn为六方最密堆积,其配位数是_______________。
(6)在硒化锌ZnSe晶胞中,Se2—离子作面心立方最密堆积,且Se2—与Se2—之间的最短距离为a nm,则晶胞边长为_____________ nm。
(7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属键的叙述错误的是( )。
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C. 金属键中的电子属于整块金属
D. 金属的性质和金属固体的形成都与金属键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
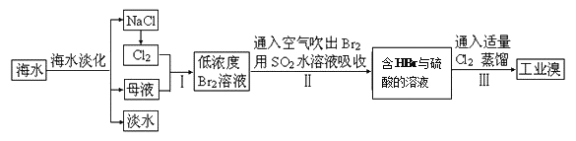
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:
______________________________________________________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________。写出步骤Ⅱ中发生反应的化学方程式:_______________________________________________。
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
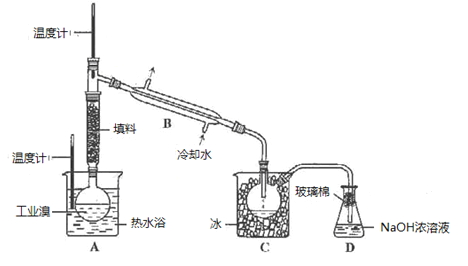
①图中仪器B的名称是________,冷却水的出口为____(填“甲”或“乙”)。
②C中液体的颜色为__________________。
③D装置的作用是__________________。
(5)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的________。(填选项)
A.![]() B. C.
B. C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.碳酸、次氯酸、亚硫酸均为弱电解质
C.烧碱、冰醋酸、四氯化碳均为电解质
D.氯化钠溶液、硫酸均为强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
A. z=2 B. 2 s后,容器内的压强是初始的7/8倍
C. 2 s后,B的浓度为0.5 mol/L D. 2 s时C的体积分数为2/7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com