
| A. | 铜基态原子核外电子排布式为1s22s22p63s23p64s13d10 | |
| B. | 在d轨道中电子排布成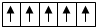 而不是 而不是 ,其最直接的根据是泡利原理 ,其最直接的根据是泡利原理 | |
| C. | 下列轨道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反应、激光、霓虹灯光等与原子核外电子发生跃迁释放能量有关 |
分析 A.多电子原子中核外电子分层排布,由内到外,能量由低到高;
B.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同;
C.各能级能量高低顺序为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s,2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,以此解答该题;
D.焰色反应、激光、霓虹灯光等是原子的发射光谱,与原子核外电子发生跃迁有关.
解答 解:A.多电子原子中核外电子分层排布,由内到外,能量由低到高,则铜基态原子核外电子排布式为1s22s22p63s23p63d104s1,故A错误;
B.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,所以在d轨道中电子排布成 而不是
而不是 ,其最直接的根据是洪特规则,故B错误;
,其最直接的根据是洪特规则,故B错误;
C.各能级能量高低顺序为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s,2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f…,所以由高到低排列的E5s>E3d>E4s>E2p>E1s,故C错误;
D.电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化,焰色反应、激光、霓虹灯光时原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,故D正确;
故选D.
点评 本题考查核外电子排布,洪特规则等侧重于基础知识的考查,为高考高频考点,题目难度中等,注意把握洪特规则和泡利不相容原理.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 原因分析 |
| A | 浓硫化钠溶液有臭味 | 硫离子水解生成硫化氢,硫化氢具有臭味 |
| B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C | SO 2通入溴水中,溴水褪色 | SO 2具有漂白性,使其褪色 |
| D | 向饱和Na2CO3溶液中通入足量CO2气体,溶液变浑浊 | 析出了NaHCO3晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2->F->Na+>Mg2+ | B. | Na>Mg>Cl>Ar | C. | I>Br>F>Cl | D. | Na>Na+>S2->S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液 | |
| B. | 正极为Fe,负极为Zn,电解质为 Fe(NO3)3 溶液 | |
| C. | 正极为 Fe,负极为 Zn,电解质为 FeSO4 溶液 | |
| D. | 正极为 Ag,负极为 Fe,电解质为 CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2 与过量乙烷在光照下反应,生成的有机物中含有氯原子的总数为2NA | |
| B. | 1molC3H8 中含有的共用电子对数为11NA | |
| C. | 1.5g 甲基含有的质子数和电子数之和为1.8NA | |
| D. | 标况下,11.2 L癸烷含有的原子个数为16 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com