
| A. | 在反应①和②中,氯化钠均既是氧化剂,又是还原剂 | |
| B. | 在反应①中氯气是还原产物,在反应②中氢气是还原产物 | |
| C. | 若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等 | |
| D. | 若消耗等质量的氯化钠,则反应①和②中转移电子总数相等 |
分析 ①电解熔融氯化钠制钠:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,Na元素的化合价降低,Cl元素的化合价升高,所以氯化钠既是氧化剂,又是还原剂;
②电解饱和食盐水制烧碱:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2 ↑,H元素的化合价降低,Cl元素的化合价升高,所以水是氧化剂,氯化钠是还原剂;据此分析.
解答 解:①电解熔融氯化钠制钠:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,Na元素的化合价降低,Cl元素的化合价升高,所以氯化钠既是氧化剂,又是还原剂;
②电解饱和食盐水制烧碱:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2 ↑,H元素的化合价降低,Cl元素的化合价升高,所以水是氧化剂,氯化钠是还原剂;
A.由分析可知,反应②中氯化钠是还原剂,故A错误;
B.在反应①中氯气是氧化产物,在反应②中氢气是还原产物,故B错误;
C.2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑中生成1mol气体转移2mol电子,2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2 ↑中生成2mol气体转移2mol电子,故C错误;
D.若消耗1mol氯化钠,则反应①和②中转移电子均为2mol,所以消耗等质量的氯化钠,则反应①和②中转移电子总数相等,故D正确.
故选D.
点评 本题考查氧化还原反应,把握反应中的元素化合价变化为解答的关键,侧重氧化剂、还原剂以及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
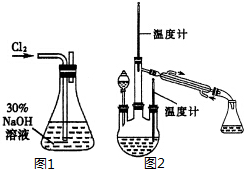 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合后所得溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
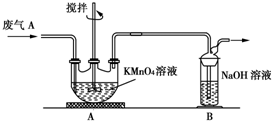 ①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.
①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.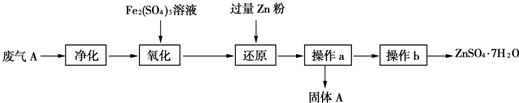
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2OH→CH3COOCH2CH3 | B. | CH2=CH2→CH3-CH2Br | ||
| C. | CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH | D. |  → → |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com