
【题目】始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是

A.始祖鸟烯与CH2===CH-CH===CH2互为同系物
B.若R1=R2=甲基,则其化学式为C12H16
C.若R1=R2=甲基,在一定条件下烯烃双键上的碳原子上的氢也能取代,则始祖鸟烯的一氯代物有3种
D.始祖鸟烯既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,且两反应的反应类型是相同的
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②Cu2(OH)2CO3![]() CuCl2
CuCl2![]() Cu
Cu
③饱和NaCl(aq)![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A.①②③④B.①②③⑤C.②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]()
![]() ,反应
,反应![]() 经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是
经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是![]()
| 0 | 50 | 150 | 250 | 350 |
| 0 |
|
|
|
|
A.反应在前50s的平均速率![]()
![]()
B.保持其他条件不变,升高温度,平衡时![]()
![]() ,则反应的
,则反应的![]()
C.相同温度下,起始时向容器中充入![]() mol
mol![]() 、
、![]() mol
mol![]() 和
和![]() mol
mol![]() ,反应达到平衡前
,反应达到平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,起始时向容器中充入![]() mol
mol![]() 和
和![]() mol
mol![]() ,达到平衡时,
,达到平衡时,![]() 的转化率小于
的转化率小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出漂白粉的有效成分的化学式:________________
②写出甘氨酸的结构简式:_______________
(2)写出苯和浓硝酸在浓H2SO4催化作用下,50~60℃时生成硝基苯的方程式:_______________
(3)相对分子质量为58的烷烃,它可能的结构简式:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸的结构简式如下图,则下列有关绿原酸的说法不正确的是
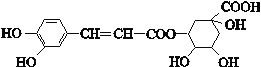
A. 分子式为C16H18O9
B. 既可以与氢气发生加成反应,又可以使酸性KMnO4溶液褪色
C. 还能发生取代、加聚、消去等反应
D. 在镍做催化剂的情况下,1 mol绿原酸发生加成反应最多可消耗6 mol 氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入____极 (填a或b)。a极发生电极反应式为:____________
II.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下( 累计值,体积已换算成标准状态) :

(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_______ ,原因是______________
(2)哪一时间段的反应速率最小________,原因是_________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率( 设溶液体积不变)________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A. 蒸馏水 B. NaCl溶液C. Na2CO3溶液D. CuSO4溶液
可行的是(填编号)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
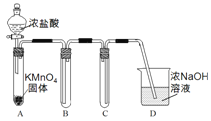
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023
B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) =0.1 mol/L
C.1 L 0.1 mol/L NH4Cl溶液中的NH![]() 数是0.1×6.02×1023
数是0.1×6.02×1023
D.标准状况下2.24 L Cl2中含有0.2 mol 共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com