
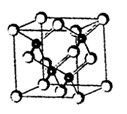
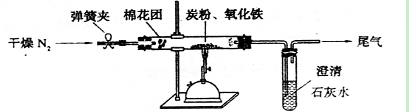
 N2↑+2H2O。
N2↑+2H2O。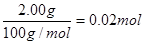 ,质量是0.88g。根据④可知反应中生成的气体共48.48g+3.2g+2.0g-52.24g=1.44g,因此CO的质量是1.44g-0.88g=0.56g,其物质的量是
,质量是0.88g。根据④可知反应中生成的气体共48.48g+3.2g+2.0g-52.24g=1.44g,因此CO的质量是1.44g-0.88g=0.56g,其物质的量是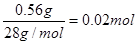 。即CO和CO2的体积之比是1︰1。所以反应式为2C + Fe2O3
。即CO和CO2的体积之比是1︰1。所以反应式为2C + Fe2O3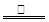 2Fe + CO↑ + CO2↑。
2Fe + CO↑ + CO2↑。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | H2 | O2 | F2 | OH | OF | HF |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.先生成白色沉淀,加入足量氨水后沉淀消失 |
| B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
| C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl |
| D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
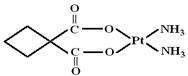
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.③⑤⑦ | B.⑤⑦ | C.③⑤ | D.⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.离子键 | B.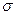  键 键 | C.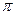 键 键 | D.氢键 E.配位键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com