
【题目】[化学——选修5:有机化学基础](15分) 化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为。
(2)B的化学名称为。
(3)C与D反应生成E的化学方程式为。
(4)由E生成F的反应类型为。
(5)G是分子式为。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为、。
【答案】
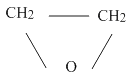
(1)
(2)2-丙醇
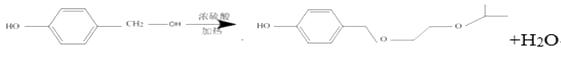
(3)
(4)取代反应
(5)C18H31NO4
(6)7;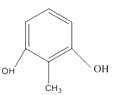 ;
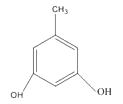
;
【解析】A的化学式为C2H4O,其核磁共振氢谱为单峰,则A为 ![]() ;B的化学式为C3H8O,核磁共振氢谱为三组峰,峰面积比为6∶1∶1,则B的结构简式为CH3CH(OH)CH3;D的化学式为C7H8O2 , 其苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应,则苯环上有酚羟基和—CH2OH,且为对位结构,则D的结构简式为
;B的化学式为C3H8O,核磁共振氢谱为三组峰,峰面积比为6∶1∶1,则B的结构简式为CH3CH(OH)CH3;D的化学式为C7H8O2 , 其苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应,则苯环上有酚羟基和—CH2OH,且为对位结构,则D的结构简式为 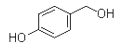 ;(1)A的结构简式为
;(1)A的结构简式为 ![]() ;(2)B的结构简式为CH3CH(OH)CH3 , 其化学名称为2-丙醇;(3)HOCH2CH2OCH(CH3)2和
;(2)B的结构简式为CH3CH(OH)CH3 , 其化学名称为2-丙醇;(3)HOCH2CH2OCH(CH3)2和  发生反应生成E的化学方程式为:
发生反应生成E的化学方程式为: ![]() ;(4)
;(4) ![]() 和
和 ![]() 发生取代反应生成F;(5)有机物G的分子式为C18H31NO4;(6)L是
发生取代反应生成F;(5)有机物G的分子式为C18H31NO4;(6)L是  的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,说明L的分子结构中含有2个酚羟基和一个甲基,当二个酚羟基在邻位时,苯环上甲基的位置有2种,当二个酚羟基在间位时,苯环上甲基的位置有3种,当二个酚羟基在对位时,苯环上甲基的位置有1种,只满足条件的L共有6种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为
的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,说明L的分子结构中含有2个酚羟基和一个甲基,当二个酚羟基在邻位时,苯环上甲基的位置有2种,当二个酚羟基在间位时,苯环上甲基的位置有3种,当二个酚羟基在对位时,苯环上甲基的位置有1种,只满足条件的L共有6种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为 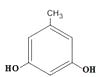 、
、 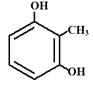 。
。


科目:高中化学 来源: 题型:
【题目】Y元素最高正价与负价的绝对值之差是4,Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A. K2SB. Na2SC. Na2OD. KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢与浓硫酸的反应为3H2S+H2SO4=4S↓+4H2O,下列说法正确的是( )
A. 硫化氢气体被氧化成硫B. 硫酸被氧化成硫
C. 硫酸被还原成水D. 硫化氢气体被还原成水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下: ①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3-242kJ·mol-1
O2(g)= H2O(g) ΔH3-242kJ·mol-1
反应①的ΔH1为 kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列试剂中,能够鉴别BaCl2 、NaCl 、Na2CO3的最佳试剂是( )
A. 稀盐酸 B. NaOH溶液 C. 稀硫酸 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) ![]() 2CO2(g)+S(s)
2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,若升高温度,CO体积分数增大,则该反应的△H>0
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( ) 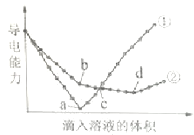
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH﹣
C.c点,两溶液中含有相同量的OH﹣
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是( )
A. 胶体粒子直径在1-100 nm之间 B. 胶体粒子带电荷
C. 胶体粒子不能穿过半透膜 D. 胶体粒子能够发生布朗运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,FeS的Ksp=6.25×10﹣18(设饱和溶液的目睹为1g/mL),若已知H2S饱和溶液在常温下,c(H+)与c(S2﹣)之间存在以下关系:c2(H+)c(S2﹣)=1.0×10﹣22 , 该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1mol/L,应调节溶液的pH= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com