
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
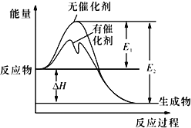
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能小于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
【答案】D
【解析】
A.由图可知,反应物总能量大于生成物总能量,为放热反应,则该反应的逆反应为吸热反应,且升高温度,提供了能量,提高了活化分子的百分数,故A正确;
B.催化剂不改变反应的反应热,能够降低反应的活化能,由图可知△H=E1-E2,故B正确;
C.该反应为放热反应,焓变等于断裂化学键吸收的能量减去形成化学键释放的能量,则该反应中反应物的总键能小于生成物的总键能,故C正确;
D.该反应为可逆反应,但热化学方程式中为完全转化时的能量变化,则1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)2SO3(g)△H<-2a kJmol-l,故D错误;
故选D。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】有四位同学分别对四种溶液中所含的离子进行检测,结果如下,其中错误的是
A.Ca2+HCO3-Cl-K+B.OH-CO32-Cl-K+
C.Ba2+Na+OH-NO3-D.Cu2+ NO3-OH-Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),已知其中一种化合物的化学式为KCuCl3,下列有关说法中错误的是( )
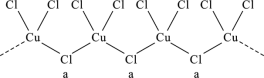
A. a位置上Cl原子的杂化轨道类型为sp3
B. 另一种的化学式为K2CuCl3
C. 铜元素在周期表中位于d区
D. 该物质中存在配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下 ①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2 mol NH3,这四种气体的关系表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是进行科学探究的重要途径,观察下图的实验装置,回答下面的问题。
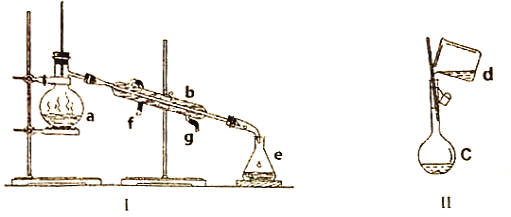
(1)写出下列仪器的名称:a:________________,b:________________,c:_________________。
(2)仪器c在使用前必须进行的操作是____________________________________________________。
(3)若用装置I制取少量蒸馏水,实验时a中除加入自来水外,还需加入_________________________,其作用是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾在南充求学和工作过的青年学者孙旭平及其领衔团队,近日成功利用Mo2N纳米催化剂在0.1mol·L1盐酸溶液中进行电催化固氮,装置如图所示,在一定电压下具有较高的产氨速率。下列判断错误的是

A. Mo2N/GCE电极为阴极
B. 溶液中H+通过隔膜向MoN/GCE电极区迁移
C. Mo2N/GCE电极区反应式为N2+6H++6e====2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_____。
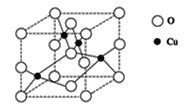
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________。
(4)Cu2O的熔点比Cu2S的_________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含0.2 molNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含0.5molBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.0.3mol·L-1B.1.6mol·L-1
C.0.6mol·L-1D.0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是

①铜为负极,锌为正极;②铜极上有气泡;③SO42-向铜极移动;④锌发生还原反应;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-=Zn2+
A. ①②B. ①④⑥
C. ②④⑥D. ②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com