
 ,故答案为:
,故答案为: ;
;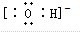 ,故答案为:
,故答案为: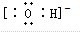 ;
; 

科目:高中化学 来源: 题型:
| A、常温下,浓度均为0.05 mol/L的A、B两种溶液各20 mL相混合 |
| B、-10℃时,浓度均为0.1 mol/L的A、B两种溶液各50 mL相混合 |
| C、常温下,浓度均为0.15 mol/L的A、B两种溶液各100 mL相混合 |
| D、-10℃时,浓度均为0.1 mol/L的A、B两种溶液各40 mL相混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为探究乙烯和溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH
为探究乙烯和溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH| 浓H2SO4 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生化学反应时得到电子越多,非金属原子的氧化能力越强 |
| B、金属阳离子被还原后,一定得到该元素的单质 |
| C、核外电子数相同的原子,一定是同种元素的原子 |
| D、能与酸反应的氧化物,一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+(g)+Cl-(g)═NaCl(s)△H | ||
B、Na(s)+
| ||
| C、Na(g)-e-═Na+(g)△H2 | ||
| D、Cl(g)+e-═Cl-(g)△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com