
元素X的原子核内只有1个质子.元素Y的阳离子电子层结构和氖原子电子层结构相同,Y、Z和E在周期表里位于同一周期.X和E、Z分别能形成气态氢化物XE和X2Z,它们的水溶液是酸.Z跟Y能形成离子化合物Y2Z.与氖同周期的元素F的气态氢化物FX3,其水溶液能使酚酞试液变红.则X、Y、Z、E、F的元素符号是
A. H、Na、S、Cl、N B. H、Na、S、Br、P
C. H、Li、O、F、N D. H、Mg、S、O、N
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:填空题
铜及其化合物在日常生活中应用广泛。某研究性学习小组欲从氯化铁溶液腐蚀印刷电路极后的酸性废液中(含FeCl3、FeCl2含CuCl2)制备氯化铜晶体(CuCl2·2H2O),设计路线如下:

回答下列问题:
(1)检验酸性废液中含有Fe3+,常用的试剂是 (填化学式);酸性废液中加入足量Cl2,反应的化学方程式为 。
(2)操作1的名称是 ;调节溶液的pH时适宜选用下列试剂中的 ;
A.NaOH溶液 B.Na2CO3 C.氨水 D.CuO
若调节溶液的pH为4时,溶液中残留的Fe3+物质的量浓度为 (已知25℃时,Kap[Fe(OH)3]=4×10-38).
(3)操作2需在氯化氢气流中经过加热浓缩、 、过滤、洗涤、干燥。在氯化氢气流中进行操作的原因是 (结合离子方程式并简要说明)。
(4)若在溶液2中通入一定量的SO2,加热,则生成CuCl沉淀,该反应的离子方程式为 。
(5)该小组设想以铜棒和石墨棒为电极,以KI溶液为电解液,利用电解来制取碘化亚铜,
已知:2Cu2++4I-=2CuI↓+I2.若按其设想,铜棒应连接电源的 (填“正”或“负”)极;阴极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,即原子的利用率为100%。下列反应类型中能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应
A.①②⑤ B.②⑤⑥ C.③④ D.只有⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
在如右图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是
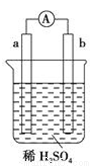
A.碳棒上有气体放出,溶液pH变大
B.a是正极,b是负极
C.稀硫酸中有电子流动,方向是从b极到a极
D.a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高二上学期入学考试化学试卷(解析版) 题型:填空题
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O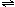 HCl+HClO K=4.5×10-4。次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
HCl+HClO K=4.5×10-4。次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为__________________________。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为________________________。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为____________________。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图)。
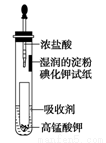
①下列溶液能吸收Cl2的是________(填字母序号)。
A.饱和食盐水
B.饱和Na2SO3溶液
C.饱和NaOH溶液
D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是_________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高二上学期入学考试化学试卷(解析版) 题型:选择题
下列关于钠的化合物的叙述,错误的是:
A.硫酸钠晶体俗称芒硝,它是造纸的重要原料
B.澄清的石灰水中滴加碳酸钠溶液有白色沉淀,滴加碳酸氢钠无白色沉淀
C.氟化钠是一种农药,可杀灭地下害虫
D.碳酸氢钠不适合给胃溃疡病人使用
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:选择题
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加人AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
A.仅有实验①可推出肯定含有SO42-,不含Cl-
B.该无色溶液肯定含有NH4+、K+、Al3+、SO42-
C.该无色溶液中肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I-
D.不能确定该无色溶液是否含有K+
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A. Cl2+2Br-=2Cl-+Br2、Zn+Cu2+=Zn2++Cu均为单质被还原的置换反应
B.2Na2O2+2H2O=4NaOH+O2↑、Cl2+H2O=HCl+HClO均为水作还原剂的氧化还原反应
C.Cl2在化学反应中只表现氧化性
D.BaSO3与H2O2的反应为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省淄博市高二上学期开学测化学试卷(解析版) 题型:选择题
有关Na、Mg两种元素的性质叙述正确的是
A. 金属性:Na<Mg
B. 原子半径:Na>Mg
C. 单质的还原性:Na<Mg
D. 最高价氧化物对应水化物的碱性:NaOH<Mg(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com