
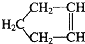
 可简写为
可简写为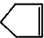 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: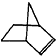
分析 (1)降冰片含有碳碳双键且只含C、H元素,没有苯环结构,属于不饱和烃;
(2)根据结构简式确定分子式;
(3)降冰片中含有碳碳双键,具有烯烃性质,能发生氧化反应、加成反应、还原反应.
解答 解:(1)降冰片含有碳碳双键且只含C、H元素,没有苯环结构,属于不饱和烃,故选b;
(2)由有机物结构简式可知有机物分子式为C7H10,故答案为:C7H10;
(3)分子中含有碳碳双键,可发生加成、氧化反应,烃类物质都不溶于水,且碳原子数大于4,常温下为液体,故答案为:bc.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意键线式中C、H原子个数判断方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 12个碳原子不可能都在同一平面上 | |
| B. | 处于同一直线上的原子最多有4个 | |
| C. | 处在同一平面上的原子最多有20个 | |
| D. | 除苯环外的其余碳原子有可能都在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu---Cu(OH)2 | B. | H2O2--O2 | C. | CaCO3---CaCl2 | D. | K2CO3--KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ?mol-1 | |
| C. | 已知:H2(g)+F2(g)═2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 该物质可能含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和果糖互为同分异构体 | |
| B. | 淀粉、油脂、蛋白质均能发生水解反应 | |
| C. | 乙醇可使酸性高锰酸钾溶液褪色 | |
| D. | 苯和溴水在FeBr3的条件下可制得溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
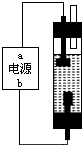 饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com