
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

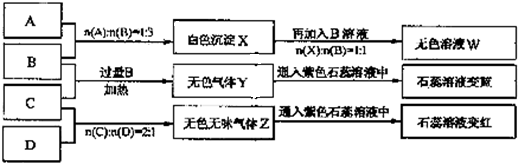
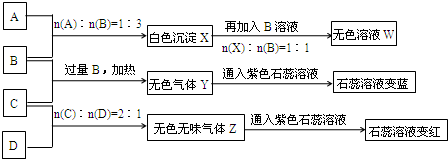
请完成下列各题:
(1)Y、Z的化学式分别为Y___________;Z___________。X与B反应的离子方程式为____________________。
(2)D溶液pH______________7(填“大于”“小于”或“等于”),原因是(用离子方程式表示)____________________________________________________________________。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是____________________。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式____________________。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com