

| 5.6L |
| 22.4mol/L |
| 36g |
| 50g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:阅读理解
I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是 Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生称FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是
⑵设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在溶液中加KSCN溶液 |
| 固体物质中有FeCl3 |
在KMnO4溶液中加少量A 溶液 | KmnO4溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:

⑶①写出一个能证明还原性Fe比Cu强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:


四位同学的设计的原电池装置图,符合上述反应原理的是 。
③请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南景洪第一中学高一上期末考试化学试卷(带解析) 题型:实验题
(I)电子工业常用30%的FeCl3。溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)检验溶液中Fe3+存在的试剂是
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。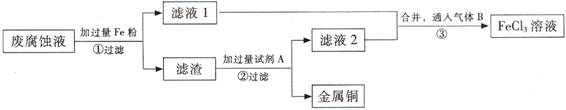 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式
(4)滤渣的主要成分是 , (填化学式)。
(5)为了除去滤渣中的杂质得到铜,需加入的试剂A是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:填空题
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中
FeO(s)+CO(g) Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
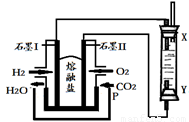
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014届云南景洪第一中学高一上期末考试化学试卷(解析版) 题型:实验题
(I)电子工业常用30%的FeCl3。溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)检验溶液中Fe3+存在的试剂是
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
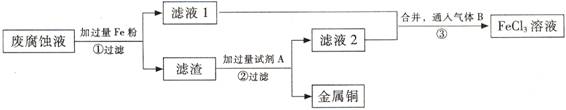 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式
(4)滤渣的主要成分是 , (填化学式)。
(5)为了除去滤渣中的杂质得到铜,需加入的试剂A是 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com