
A、
| ||
B、
| ||
C、
| ||
| D、MC |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:






| 一定条件 |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)非金属元素氮有多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是和
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
(1)写出NO2转化为N2O4的热化学方程式_________________________________________
(2)对反应2NO2(g) N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为___ __。
②2NO2(g) N2O4(g)该反应的平衡常数K的值为 ;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
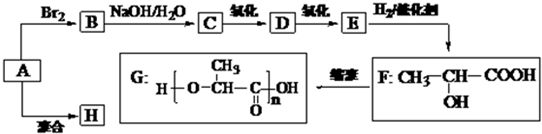
科目:高中化学 来源:2013届贵州省湄潭中学高三上学期期末考试化学试卷(带解析) 题型:推断题
(16分)某烃A是乙烯的同系物,A与乙烯一样,都是重要的化工原料。已知A与氢气的相对 密度为21,由A经下列反应可得到G、H两种高分子化合物,它们都是常用的塑料。
请回答下列问题:
(1)E不能使溴的四氯化碳溶液褪色,E的结构简式为____ ;
(2)由A生成B和H的反应方程式分别为 ; ;
(3)一定条件下,2 molF之间脱去1 mol水生成一种具有芳香气味的物质I,写出反应的化学方程式 ;
(4)I能发生的反应有: ;
| A.取代反应 |
| B.消去反应 |
| C.水解反应 |
| D.中和反应 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年贵州省高三上学期期末考试化学试卷(解析版) 题型:推断题
(16分)某烃A是乙烯的同系物,A与乙烯一样,都是重要的化工原料。已知A与氢气的相对 密度为21,由A经下列反应可得到G、H两种高分子化合物,它们都是常用的塑料。
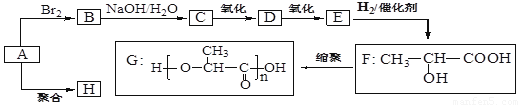
请回答下列问题:
(1)E不能使溴的四氯化碳溶液褪色,E的结构简式为____ ;
(2)由A生成B和H的反应方程式分别为 ; ;
(3)一定条件下,2 molF之间脱去1 mol水生成一种具有芳香气味的物质I,写出反应的化学方程式 ;
(4)I能发生的反应有: ;
A.取代反应
B.消去反应
C.水解反应
D.中和反应
E.氧化反应
(5)F的一种同分异构体中有五种不同化学环境的氢且能发生银镜反应,写出其结构简式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(15分)非金属元素氮有多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
(1)写出NO2转化为N2O4的热化学方程式_________________________________________
(2)对反应2NO2
(g) N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(
)
N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(
)

A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为___ __。
②2NO2(g) N2O4(g)该反应的平衡常数K的值为
;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2
N2O4(g)该反应的平衡常数K的值为
;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2 N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com