
[ ]
科目:高中化学 来源: 题型:
| 物质 | 金刚石 | 石墨 |
| 外观 | 无色,透明固体 | 灰黑,不透明固体 |
| 熔点 | ? | ? |
| 燃烧热/KJ?mol-1 | 395.4 | 393.5 |
A、表示石墨燃烧热的热化学方程式为C(石墨,s)+
| ||
| B、由表中信息知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ?mol?? | ||
C、由表中信息可得如图所示的图象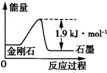 | ||
| D、由表中信息可推知相同条件下金刚石的熔点高于石墨的 |
查看答案和解析>>
科目:高中化学 来源:启东市汇龙中学2006~2007学年度第一学期高二年级期中考试 化学试卷 题型:022
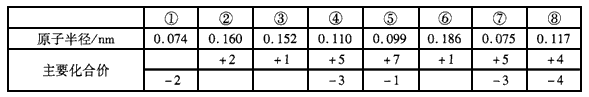
| |||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com