
下列说法不正确的是 ( )
A.2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标
B.核磁共振仪、红外光谱仪、质谱仪等都可用于有机化合物结构的分析
C.石油裂解、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化
D.亚硝酸盐属于食物防腐剂,可以适量地添加于食物中
科目:高中化学 来源: 题型:
现取有机物A 3.00g与4.48L(标准状况)氧气在密闭容器中燃烧,燃烧后产物只有二氧化碳、—氧化碳和水蒸气(没有反应物剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.60g,碱石灰增重4.40g。回答下列问题:
(1)3.00gA中所含氢原子为 mol、碳原子为 mol。
(2)该有机物的分子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为制取乙酸乙酯的实验装置图。回答下列问题:
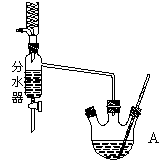
揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
②能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:

(1)已知由①、③、④三种元素组成的某种常见化合物的水溶液呈酸性,则符合该条件的化合物的化学式可能为 (至少写两种)。
(2)由表中①、④两种元素按原子个数比为1∶1构成的化合物的稀溶液易被催化分解,通常使用的催化剂为 (填序号)。
a. MnO2 b. FeCl3 c、Na2SO3 d、KMnO4
(3)下图中A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:

Ⅰ.若B为黄色固体,A为原子半径最小的原子组成的单质。
①F的电子式为 。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是 。
Ⅱ.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是 (填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法不正确的是 ( )
A.标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA
B.常温常压下,17g甲基(-14CH3)所含的电子数为9NA
C.同温同压下,1L NO和1L O2充分混合体积小于1.5L
D.pH=l的醋酸溶液100mL中氢离子数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或对实验事实的叙述正确的是 ( )
①用稀盐酸洗涤盛放过石灰水的试剂瓶
②配制FeCl3溶液时,向溶液中加入少量Fe粉和稀盐酸
③用pH试纸测得氯水的pH为2
④用稀硝酸清洗做过银镜反应实验的试管
⑤浓硝酸保存在棕色细口瓶中
⑥将镁条和铝片用导线连接再插进稀NaOH溶液,铝条上产生气泡
⑦某溶液加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,则原溶液中含NH4+
⑧清洗试管内壁的MnO2用双氧水
A.①④⑤⑦ B.②③④⑦ C.①②⑥⑧ D.①⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.金属性:Y>Z B.氢化物的沸点:X>W
C.离子的还原性:X>W D.离子半径:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中SO2和NOx是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Mg2+、NH 、Cl-、SO
、Cl-、SO 、SO
、SO 、NO
、NO 和NO
和NO 等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。21教育网
等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。21教育网
[已知:Ksp(Ag2SO4)=1.20×10-5]
请回答下列问题:
(1)该酸雨中肯定存在的离子有 SO 、NO
、NO 、NH
、NH ;肯定不存在的离子有 SO
;肯定不存在的离子有 SO 、NO
、NO ,说明其不存在的理由:________________________________________________________________________
,说明其不存在的理由:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
(3)设计实验方案,检验该试液中是否存在Cl-:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有________________________________________________________________________、
________________________________________________________________________,
再喷射适量蒸馏水即得硫酸型酸雨。说明NO的作用: 催化剂 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com