
【题目】某科研小组取用0.2 L营养液进行实验。该营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度如下表所示。
离子符号 | K+ | SO | Cl- |
物质的量浓度(mol·L-1) | 9.0 | 4.0 | 9.0 |
(1)该营养液中K2SO4的物质的量浓度为________,含溶质KCl的质量为________。
(2)该营养液中NH4Cl的物质的量为________。
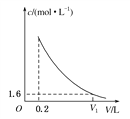
(3)该营养液加水稀释的过程中测得溶液中NH![]() 的物质的量浓度(c)随溶液体积(V)变化的曲线如图所示,则V1为________L。此时营养液中KCl的物质的量浓度为________。
的物质的量浓度(c)随溶液体积(V)变化的曲线如图所示,则V1为________L。此时营养液中KCl的物质的量浓度为________。
【答案】 4 mol·L-1 14.9 g 1.6 mol 1 0.2 mol·L-1
【解析】(1)硫酸根离子物质的量浓度为4.0mol/L,则硫酸钾的物质的量浓度为:c(K2SO4)=c(SO42-)=4.0mol/L;根据钾离子守恒可知,c(K+)=c(KCl)+2c(K2SO4),则c(KCl)=c(K+)-2c(K2SO4)=9.0mol/L-4.0mol/L×2=1.0mol/L,溶质氯化钾的质量为:m(KCl)=McV=74.5g/mol×1.0mol/L×0.2L=14.9g;(2)根据氯原子守恒可知,c(Cl-)=c(KCl)+c(NH4Cl),则:c(NH4Cl)=c(Cl-)-c(KCl)=9.0mol/L-1.0mol/L=8.0mol/L,
氯化铵的物质的量为:n(NH4Cl)=8.0mol/L×0.2L=1.6mol;(3)据c=n/V可知V=n/c,V1=n/c1=1.6mol÷1.6mol/L=1L,此时营养液中KCl的物质的量浓度为0.2mol÷1L=0.2mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】[2015·新课标全国卷Ⅱ]NA代表阿伏加德罗常数的值。下列叙述正确的是
A.60 g丙醇中存在的共价键总数为10NA
B.1 L 0.1 mol·L1的NaHCO3溶液中![]() 和
和![]() 离子数之和为0.1NA
离子数之和为0.1NA
C.钠在空气中燃烧可生成多种氧化物。23 g钠充分燃烧时转移电子数为1NA
D.235 g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]()
![]() +
+![]() +10
+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10NA
)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是( )
A. Cl- B. SO42- C. OH- D. Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是
① 将10.6 g Na2CO3 溶于100mL水中
② 将28.6g Na2CO3·10H2O溶于水配成100 mL溶液
③ 将20 ml 5.0 mol/L Na2CO3溶液加水稀释至100 mL
A. ①②③ B. ②③ C. 只有② D. 只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质或结构中含有糖类的是( )
①ATP ②DNA ③染色体 ④细胞膜 ⑤脂肪 ⑥淀粉酶
A. ①②③④ B. ①③④⑥ C. ①②③⑥ D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al2O3常用于制造耐火坩埚,但氧化铝坩埚不能用于加热熔融下列化合物中的( )
A.NaCl B.NaNO3 C.NaOH D.Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式如图:下列有关A的性质叙述中,正确的是( )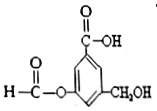
A. A与金属钠完全反应时,两者反应的物质的量之比为1∶3
B. lmolA最多能与5mol氢气发生反应,反应类型是加成反应
C. 1molA与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol
D. A既能与羧基反应,又能与醇反应,还能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
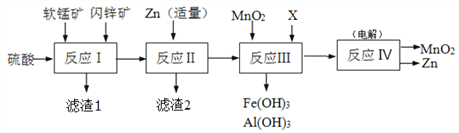
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com