


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
 2MgO
2MgO Al2O3+2Fe
Al2O3+2Fe CaO+CO2↑
CaO+CO2↑查看答案和解析>>
科目:高中化学 来源: 题型:单选题
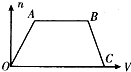 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入的CO2体积(V)的关系如图所示,图中AB段表示的先后反应的离子方程式是
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入的CO2体积(V)的关系如图所示,图中AB段表示的先后反应的离子方程式是
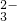 +H2O
+H2O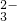 +Ba2+═BaCO3↓
+Ba2+═BaCO3↓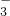
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
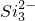 +2H+═H2SiO3↓
+2H+═H2SiO3↓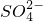 +3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓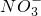 +6H+
+6H+ Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
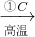 Si(粗)
Si(粗)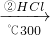 SiHCl3
SiHCl3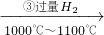 Si(纯)
Si(纯)查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com