(2011?开封一模)[化学--选修物质结构与性质]
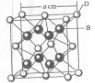
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如图.请回答:
(1)A与c形成的共价化合物的分子式是
SiH4
SiH4
,杂化轨道是
sp3
sp3
,分子的立体结构是
正四面体
正四面体
.
(2)B与C比较,电负性较小的是
Si
Si
(填元素符号);B与c形成的化合物晶体类型是
分子晶体
分子晶体
.
(3)E属元素周期表中第
四
四
周期,第
ⅡB
ⅡB
族的元素,其元素名称是
锌
锌
,它的+2价离子的电子排布式为
1s22s22p63s2sp63d10
1s22s22p63s2sp63d10
.
(4)从图中可以看出,D踉B形成的离子化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
(只要求列出算式).

 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]



