
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是 ( )

A. Y元素的气态氢化物易液化,是因为其分子间能形成氢键
B. X元素最高价氧化物分子的比例模型为
C. Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D. W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
科目:高中化学 来源:2016-2017学年浙江省高二上10月月考化学试卷(解析版) 题型:选择题
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)  2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)
2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y) 的变化一定符合图中曲线的是( )
的变化一定符合图中曲线的是( )
X |
| |
A | 再加入A | B的转化率 |
B | 再加入B | A的体积分数 |
C | 减小压强 | A的转化率 |
D | 升高温度 | 混合气体平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
标准状况下,①6.72 L NH3 ②1.204×1023个 H2S ③5.6 g CH4 ④0.5 mol HCl ,下列关系正确的是
A、体积大小: ④>③>②>① B、原子数目: ③>①>④>②
C、密度大小:④>②>③>① D、质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子;A与C,B与D均为同主族元素。下列叙述正确的是( )
A. B元素组成的一种单质具有漂白性,能使KMnO4溶液紫色褪去
B. B、D两种元素形成的一种化合物也具有一定的漂白性,能使紫色石蕊紫色褪去
C. C元素分别与A、B元素形成的化合物都是离子晶体,均与水反应生成强碱和无色气体
D. A2B的热稳定性强于A2D、沸点也高于A2D,但解释的理由不相同
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
由短周期元素组成的中学常见物质A、B、C、D、E、X,存在下图转化关系:
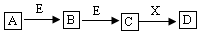 (部分生成物和反应条件略去)。下列推断错误的是( )
(部分生成物和反应条件略去)。下列推断错误的是( )
A. 若D与盐酸反应,可生成A和B,则X一定是H2O
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
已知H2(g)、CO(g)、CH3OH(l)的燃烧热 H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:
CH3OH(l)+O2 (g)= CO(g)+2H2O(l) △H1=-1009.5kJ·mol-1
B.CH3OH(l)+1/2O2 (g)= CO2(g)+2H2 (g) △H1=-440.7kJ·mol-1
C.2H2O( g) = 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
g) = 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
D.已知:S(s)+O2(g) = SO2(g) △H1 ;S(g)+O2(g) = SO2(g) △H2 ;则△H1>△H2
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学卷(解析版) 题型:实验题
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4,摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)Na2FeO4之所以能净水、杀菌、消毒,原因是 。
(2)已知二氧化氯是一种黄绿色有刺激性气味的有毒气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。用下图所示的装置模拟工业制取及收集ClO2。
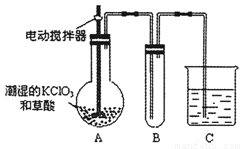
①A中反应产物有K2CO3、ClO2等,请写出反应方程式 。
②A部分还应添加温度控制装置,如水浴加热或酒精灯、温度计,B部分还应补充的装置为 (说明原因)。
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是 (填“A”“B”或“C”),请画出正确的装置图。
④ClO2需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10ml,稀释成100ml试样;量取V1ml试样加入锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用cmol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2ml。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
步骤2的目的 (用离子方程式表示)。当 时,可以判断此滴定操作达到终点;由以上数据可以计算原ClO2溶液的浓度为 g/L(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学卷(解析版) 题型:选择题
下列实验设计能完成或实验结论合理的是
A. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
B. NH4Cl固体中混有少量的I2,可用加热的方法将I2除去
C. 用浓硫酸吸收二氧化硫中混有少量SO3气体
D. 少量金属锂保存在煤油中
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省高三10月月考化学卷(解析版) 题型:选择题
某兴趣小组设计如图所示微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1、闭合K2,发现电流表A指针偏转。下列有关描述正确的是( )
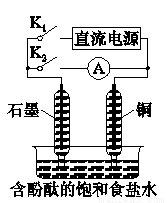
A.断开K2,闭合K1时,总反应的离子方程式为:
2H++2Cl-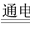 Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com