
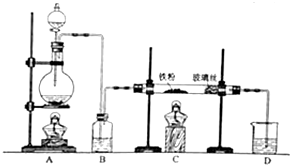
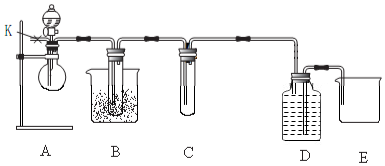
 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.分析 (1)混合液体时,先加乙醇,再加浓硫酸,最后加乙酸,防止液体飞溅,且提高原料的利用率;
(2)乙醇、乙酸易溶于水,导管在液面下可发生倒吸;
(3)酯化反应为可逆反应,浓硫酸具有吸水性;
(4)饱和碳酸钠溶液吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(5)乙酸乙酯的密度比水的密度小;
(6)反应温度达到140℃左右时,发生取代反应生成乙醚.
解答 解:(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是先将乙醇先加入试管中,后加入浓硫酸,最后加乙酸,然后轻轻地振荡试管,使之混合均匀,
故答案为:先将乙醇先加入试管中,后加入浓硫酸,最后加乙酸;
(2)防止Na2CO3溶液的倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液,
故答案为:乙酸和乙醇都易溶于Na2CO3溶液;
(3)酯化反应为可逆反应,浓硫酸具有吸水性,则浓硫酸的作用为①作催化剂;②吸水剂,吸收生成的水,以利于平衡向酯化方向移动,
故答案为:催化剂和吸收剂;
(4)饱和碳酸钠溶液的作用为除去酯中混有的酸和醇,降低酯在水中的溶解度,利于分层,
故答案为:除去酯中混有的酸和醇,降低酯在水中的溶解度,利于分层;
(5)生成的乙酸乙酯,其密度比水小,故答案为:小;
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是乙醚,故答案为:乙醚.
点评 本题考查有机物的制备实验,为高频考点,把握反应原理、实验装置的作用、混合物分离为解答的关键,侧重分析与实验能力的考查,注意试管中碳酸钠溶液的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷在O2中燃烧的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与H2O(g)反应 | D. | 铝片与稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
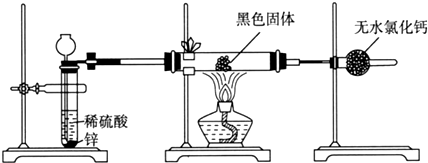
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
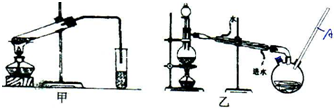
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
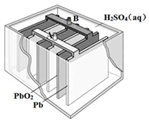 铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:| A. | 放电时,电解质溶液的PH值增大 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g | |
| C. | 放电时,溶液中H+向PbO2电极移动 | |
| D. | 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com