A
分析:A、稀溶液中铵根离子与氢氧根离子结合生成一水合氨.
B、氢氧化铝不溶于氨水,应生成氢氧化铝沉淀,一水合氨是弱电解质,应写成化学式形式.
C、铁离子具有较强的氧化性,能氧化碘离子为碘单质.
D、CH
3COONH
4是强电解质,应写成离子形式.
解答:A、稀溶液中铵根离子与氢氧根离子结合生成一水合氨,氯化铵稀溶液中滴加少量氢氧化钠稀溶液,反应的离子方程式为NH
4++OH
-═NH
3?H
2O,故A正确;
B、氢氧化铝不溶于氨水,应生成氢氧化铝沉淀,一水合氨是弱电解质,应写成化学式形式,氯化铝溶液中加入过量的氨水,反应离子方程式为Al
3++3NH
3?H
2O═Al(OH)
3↓+3NH
4+,故B错误;
C、铁离子具有较强的氧化性,能氧化碘离子为碘单质,铁红溶于足量的氢碘酸溶液中,反应离子方程式为:Fe
2O
3+2I
-+6H
+═2Fe
2++I
2+3H
2O,故C错误;
D、CH
3COONH
4是强电解质,应写成离子形式,离子方程式为CH
3CHO+2[Ag(NH
3)
2]
++2OH
-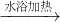
CH
3COO
-+NH
4++2Ag↓+H
2O+3NH
3,故D错误.
故选:A.
点评:考查离子方程式的书写与正误判断,难度中等,是对所学知识的综合考查,掌握离子方程式的书写与元素化合物的性质等.

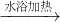 CH3COONH4+2Ag↓+H2O+3NH3
CH3COONH4+2Ag↓+H2O+3NH3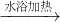 CH3COO-+NH4++2Ag↓+H2O+3NH3,故D错误.
CH3COO-+NH4++2Ag↓+H2O+3NH3,故D错误.
