
| A. | 若pH>7,则一定是c1V1≥c2V2 | |
| B. | 在任何情况下都是c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当醋酸和氢氧化钠溶液恰好完全反应后,滴加酚酞溶液,颜色变红 | |
| D. | 反应的离子方程式为:H++OH-═H20 |
分析 A.当溶液呈碱性时,溶液中氢离子浓度小于氢氧根离子浓度,但混合时醋酸的物质的量不一定等于氢氧化钠的物质的量;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等;
C.恰好反应时生成醋酸钠,醋酸钠是强碱弱酸盐,其水溶液呈碱性;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.醋酸是弱酸,氢氧化钠是强碱,所以等物质的量的酸和碱混合时,溶液呈碱性,当氢氧化钠过量时溶液更呈碱性,所以当pH>7时,则一定是c1V1≥c2V2,故A正确;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等,所以得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故B正确;
C.二者恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以滴加酚酞溶液,颜色变红,故C正确;
D.醋酸与氢氧化钠反应生成醋酸钠和水,醋酸需要保留分子式,正确的离子方程式为:CH3COOH+OH-═H20+CH3COO-,故D错误;
故选D.
点评 本题考查了酸碱混合溶液的定性判断,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确溶液中物料守恒和电荷守恒即可解答本题,该知识点为考试的热点.


科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式: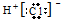 | B. | 氯离子的结构示意图: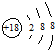 | ||
| C. | 甲烷分子的比例模型: | D. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.265mol•L-1 | B. | 0.525mol•L-1 | C. | 0.21mol•L-1 | D. | 0.42mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 组成和结构信息 |
| a | 仅由A和E两元素组成的离子化合物 |
| b | 由D和E组成的离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 化学组成为A2GD4 |
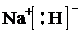 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
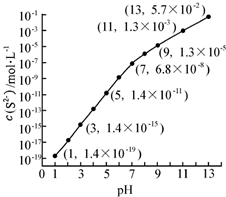 (1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
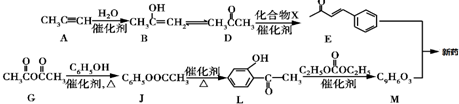
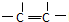
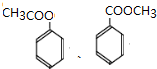 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
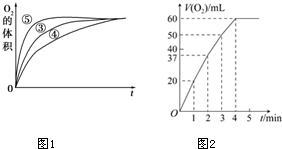 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分组实验 | 催化剂 | |
| ① | 10mL 5% H2O2溶液 | 无 |
| ② | 10mL 2% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测氯水的pH | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 中和滴定时锥形瓶使用前需用待测液润洗 | |
| D. | 用CS2可除去试管内壁残留的S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com