
化学知识在生产和生活中有着重要的应用,下列说法不正确的是( )
A.明矾常做净水剂
B.与铜质水龙头连接处的钢质水管易发生腐蚀
C.发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔
D.金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:选择题
在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是( )
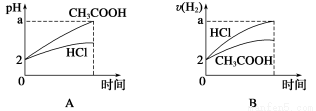
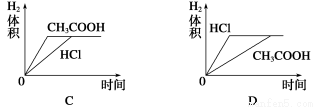
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
某化学小组用下图所示装置制取氯气,下列说法不正确的是( )

A.该装置图中至少存在两处明显错误
B.烧瓶中的MnO2可换成KMnO4
C.在乙后连一盛有饱和食盐水的烧杯可进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉?KI试纸可以证明是否有氯气逸出
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:实验题
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是________。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为
Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验:。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为________。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
操作 | 应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:______________。
实验3:进行实验以确定可能的原因。
操作 | 现象 |
向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
操作 | 现象 |
向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是________________。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:__________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是( )

A.①②④ B.②③④ C.①②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:填空题
现有七种短周期主族元素,其原子序数按A、B、C、D、E、F、G的顺序递增。A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素;C原子能形成分别含10电子、18电子的两种阴离子,且C与F位于同一主族;D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡;E的简单阳离子是同周期元素所形成的简单离子中半径最小的。回答下列问题:
(1)B位于周期表第________周期第________族。
(2)A、B、C三种元素能形成等电子体,请写出其中一组等电子体:________________________________________________________________________。
(3)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为______________(用化学式表示)。
(4)若选择三种试剂设计实验能证明非金属性:B>A>M,用化学方程式表示实验原理:__________________________________________________。
(5)A、M、F、G的最高价氧化物对应水化物的酸性由强到弱的顺序为________________________(用化学式表示)。
(6)下列实验方法能证明D与E的金属性强弱关系的是________(填字母序号)。
A.比较D和E的单质分别与稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:选择题
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是( )
A.D元素处于元素周期表中第三周期ⅥA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:填空题
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种。欲将它们一一鉴别,甲、乙、丙分别提出如下方案,请回答有关问题:
(1)甲同学用物质X一次性鉴别上述四种物质,他将适量的X溶液分别加入到四种溶液中,结果发现:C溶液变为棕黄色;B溶液中有白色沉淀产生;D溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,同时产生白色沉淀,最终变为红褐色。
B的化学式是________;D的电子式是________;X的化学式是________;A溶液中水的电离程度________(填“大于”、“小于”或“等于”)C溶液中水的电离程度。
(2)乙同学提出用明矾来鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同学用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2 中分别加入HNO3和NH4Cl溶液时,发现沉淀均溶解。有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故。
0.01 mol·L-1 电解质溶液 | HF | CH3COOH | HCN | NH3·H2O |
酸中H+或碱 中OH-的浓度/mol·L-1 | 8.00×10-4 | 1.32×10-4 | 1.00×10-4 | 1.33×10-4 |
若要证明A和B哪一种解释正确,可以在生成的Mg(OH)2沉淀中加入一种物质,这种物质的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:选择题
36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为W,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度:c=1 mol·L-1
B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:W=36.5 c/(1 000ρ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com