
【题目】Ⅰ.在下列事实中,影响化学反应速率的因素分别为:
(1)夏天将食物存放在电冰箱里___;
(2)钠可以与冷水剧烈反应,铝与水反应必须加热____;
(3)工业制氨需要高压____。
Ⅱ.向体积为2L的恒容密闭容器中充入1molN2和3molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),达到平衡时,N2的转化率为20%,回答下列问题:
2NH3(g),达到平衡时,N2的转化率为20%,回答下列问题:
(1)平衡时,c(N2):c(H2)=___,平衡转化率α(N2):α(H2)=___;
(2)设平衡时压强为P平,反应开始时压强为P始,则P平:P始=___;
(3)若起始投料改为只加入2molNH3,则相同条件达到平衡时NH3的转化率为α(NH3)=__。
【答案】温度 物质本身性质 压强 1:3 1:1 9:10 80%
【解析】
Ⅰ.(1)夏天将食物存放在电冰箱里,可以降低反应速率,与冰箱中的低温有关;
(2)钠可以与冷水剧烈反应,铝与水反应必须加热是金属本身的性质,导致不同;
(3)压强增大可以加快工业制氨的速率;
Ⅱ.(1)因为起始投料为1:3,转化的量也为1:3,所以平衡时c(N2):c(H2)=1:3,平衡转化率α(N2):α(H2)等于1:1;
(2)设平衡时压强为P平,反应开始时压强为P始,压强之比等于物质的量之比,反应前气体的物质的量为4mol,反应后气体的总物质的量为3.6mol,则P平:P始=9:10;
(3)若起始投料改为只加入2molNH3,则相同条件达到平衡时,正向投料转化率和反向投料转化率之和为1,所以相同条件达到平衡时NH3的转化率为80%。


科目:高中化学 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(![]() )是常用的还原剂。在一定体积的某维生素C(化学式
)是常用的还原剂。在一定体积的某维生素C(化学式![]() )溶液中加入
)溶液中加入![]() 溶液
溶液![]() ,使维生素C完全氧化,充分反应后,用
,使维生素C完全氧化,充分反应后,用![]() 溶液滴定剩余的I2,消耗
溶液滴定剩余的I2,消耗![]() 溶液
溶液![]() 。
。
已知发生的反应为: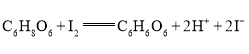
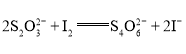 ,该溶液中维生素C的物质的量是__________mol。写出简要的计算过程__________。
,该溶液中维生素C的物质的量是__________mol。写出简要的计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
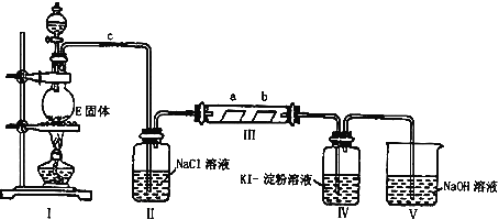
(1)有关氯气、氯水和氯离子的性质,下列说法正确的是___。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.Cl-和Cl2都具有很强的氧化性
C.新制氯水可以用来杀菌消毒是因为生成强酸次氯酸
D.将新制氯水滴入AgNO3溶液,会出现白色沉淀
(2)装置Ⅱ中饱和食盐水的作用是___。
(3)实验室以二氧化锰和浓盐酸制备氯气的离子方程式为:___。
(4)实验过程中,装置IV中的实验现象为__;发生反应的化学方程式为__。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加如图中的__装置![]() 填序号
填序号![]() ,该装置的作用是__。
,该装置的作用是__。

(6)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
H2O(g)═H2(g)+![]() O2(g)△H=+241.8kJ/mol
O2(g)△H=+241.8kJ/mol
H2(g)+![]() O2(g)═H2O(1)△H=﹣285.8kJ/mol
O2(g)═H2O(1)△H=﹣285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热44kJB.吸热2.44KJC.放热44kJD.放热2.44KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溶液中是否含有某种离子,下列操作方法正确的是 ( )
A. 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32一
B. 某溶液加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定含有NH4+
C. 某溶液滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有SO42一
D. 某溶液加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定含有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“空气吹出法”海水提溴的工艺流程如图:
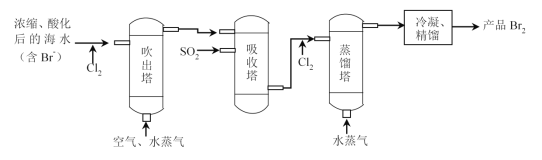
下列说法不正确的是( )
A.进入吹出塔前,Br-被氧化为Br2
B.从吸收塔流出的溶液主要含HBr和H2SO4
C.经过吸收塔后,溴元素得到富集
D.两次通入水蒸气的作用都是参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述不正确的是( )
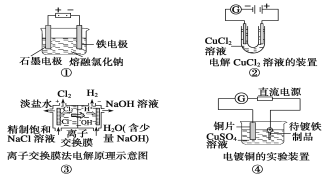
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小
C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过
D.装置④的待镀铁制品应与电源负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com