
| A. | 4mol/LNaCl溶液与2mol/LNa2SO4溶液混合后,c(Na+)为4 mol/L | |
| B. | 240 g NaCl溶液中溶有40 g NaCl,该温度下NaCl的溶解度为20g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mo1/L | |
| D. | 把5 g胆矾(CuSO4?5H2O)溶于45 g水中,所得溶液溶质的质量分数为10% |
分析 A.4mol/LNaCl溶液与2mol/LNa2SO4溶液中c(Na+)均为4 mol/L,混合后钠离子浓度不变;
B.240 g NaCl溶液中溶有40 g NaCl,该溶液不一定是饱和溶液;
C.温度、压强会影响气体摩尔体积;
D.溶液中溶质为硫酸铜,结合胆矾的化学式计算硫酸铜的质量,溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%.
解答 解:A.4mol/LNaCl溶液与2mol/LNa2SO4溶液中c(Na+)均为4 mol/L,混合后c(Na+)为4 mol/L,故A正确;
B.240 g NaCl溶液中溶有40 g NaCl,若为饱和溶液,则该温度下NaCl的溶解度为20g,但该溶液不一定是饱和溶液,故B错误;
C.HCl所处状态的温度、压强不确定,22.4L HCl的物质的量不一定是1mol,故C错误;
D.溶液中溶质为硫酸铜,硫酸铜的质量为5g×$\frac{160}{250}$=3.2g,所得溶液溶质的质量分数为$\frac{3.2g}{5g+45g}$×100%=6.4%,故D错误.
故选:A.
点评 本题考查物质的量浓度、溶解度、气体摩尔体积、质量分数等,注意对概念的理解,注意气体摩尔体积的使用对象与条件.


科目:高中化学 来源: 题型:选择题
| A. | AB2分子的空间构型为V形 | |
| B. | AB2与H2O相比,AB2的熔、沸点比H2O的低 | |
| C. | AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键 | |
| D. | A-B键为极性共价键,AB2分子为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
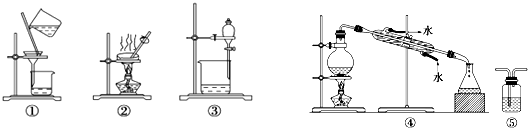
| A. | 用CCl4提取碘水中的碘,选③ | |
| B. | 用KMnO4溶液检验CH4是否含有C2H4,选⑤ | |
| C. | 粗盐提纯,选①和② | |
| D. | 石油的分馏,选④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
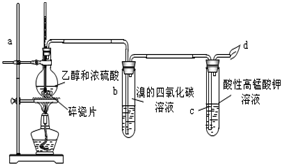
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(D)原子核外有1个电子 | |
| B. | 1H与D互称同位素 | |
| C. | 等物质的量的H2O与D2O质子数不同 | |
| D. | 1H218O与D216O的相对分子质量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com