
【题目】在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,如图表示加入固体的质量与产生气体的体积(标准状况)的关系.试计算: 
(1)NaOH溶液的物质的量浓度是molL﹣1
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为L(标准状况)
(3)当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为L(标准状况).
【答案】
(1)5
(2)15.68
(3)16.8
【解析】解:(1)氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH﹣ ![]() NH3↑+2H2O,从图中可看出34.4 g混合物和100 mL NaOH恰好完全反应.则n(NaOH)=n(NH3)=
NH3↑+2H2O,从图中可看出34.4 g混合物和100 mL NaOH恰好完全反应.则n(NaOH)=n(NH3)= ![]() =0.5 mol,c(NaOH)=
=0.5 mol,c(NaOH)= ![]() =5mol/L,所以答案是:5;(2)当固体混合物的质量是51.6 g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为
=5mol/L,所以答案是:5;(2)当固体混合物的质量是51.6 g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为 ![]() ×100mL=150mL,而V(NaOH)=140 mL,说明固体过量,所以n(NH3)=n(NaOH)=5 mol/L×0.14 L=0.7mol,V(NH3)=0.7mol×22.4 L/mol=15.68 L,所以答案是:15.68;(3)由(2)分析可知,当V(NaOH)=180 mL时,说明NaOH过量,则固体51.6 g完全反应,故V(NH3)=11.2L×
×100mL=150mL,而V(NaOH)=140 mL,说明固体过量,所以n(NH3)=n(NaOH)=5 mol/L×0.14 L=0.7mol,V(NH3)=0.7mol×22.4 L/mol=15.68 L,所以答案是:15.68;(3)由(2)分析可知,当V(NaOH)=180 mL时,说明NaOH过量,则固体51.6 g完全反应,故V(NH3)=11.2L× ![]() =16.8 L, 所以答案是:16.8.
=16.8 L, 所以答案是:16.8.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于电解质的判断中,正确的观点是( )
A. 在熔融状态下能导电的物质
B. 在水溶液或熔融状态下能导电的物质
C. 在水溶液或熔融状态下能导电的化合物
D. 在水溶液和熔融状态下都能导电的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
序号 | A | B | C | D |
实验目的 | 制取蒸馏水 | 分离水和植物油 | 分离食盐水与泥沙 | 从浓食盐水中得到氯化钠晶体 |
分离方法 | 蒸馏 | 分液 | 萃取 | 蒸发 |
选用仪器 |
|
|
|
|
A.选项A
B.选项B
C.选项C
D.选项D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应X2+3Y22Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( ) 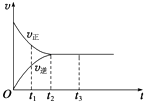
A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3 , 反应不再发生
D.t2~t3 , 各物质的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )
W | X | |||
Y | Z |
A. 氢化物沸点:W<Z
B. 氧化物对应水化物的酸性:Y>W
C. Y2X3与YZ3化合物类型相同
D. 简单离子的半径:Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50 mL 0.3 mol/L Fe2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42-物质的量浓度为
A.0.01 mol/LB.0.03 mol/LC.0.06mol/LD.0.09 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中的①~⑨中元素,用元素符号或化学式填空回答:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为___________。
(2)地壳中含量最多的金属元素是____________________________。
(3)②与④形成的化合物的电子式______________________________。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是___________,碱性最强的是____________,呈两性的氢氧化物是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份铝屑,第一份与足量稀盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1:2,则第一份与第二份铝屑的质量比为( )
A.1:1
B.2:1
C.1:3
D.1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com